Revista Canal Abierto 38 | Artículo Científico
Tratamiento regenerador pulpar en casos de necrosis pulpar con Dens Evaginatus: Reporte de casos.
Pamela Flores-Jara 1 Mejía Rojas Pierre 2 Mendiola Aquino Carlos 3
- Residente de la Especialidad de Endodoncia de la Universidad Peruana Cayetano Heredia.
- Especialista en Endodoncia de la Universidad Peruana Cayetano Heredia/ Docente Universidad Peruana Cayetano Heredia
- Especialista en Endodoncia de la Universidad Peruana Cayetano Heredia/ Docente Universidad Peruana Cayetano Heredia/ Past Presidente de la Sociedad Peruana de Endodoncia.
Resumen
Los tratamientos regeneradores pulpares se vienen realizando en endodoncia como una alternativa al tratamiento de canales tradicional en casos de necrosis pulpar en los cuales el desarrollo radicular no fue concluido en el momento de la lesión. En el presente reporte de caso se presentan dos premolares inferiores de una misma paciente con Dens Evaginatus en los cuales se siguió un protocolo en base a la literatura existente, incluyendo irrigación con NaOCl en baja concentración, EDTA al 17% y pasta triantibiótica. Luego del tratamiento, se observó una curación completa que incluyó ausencia de sintomatología, alargamiento y engrosamiento radicular, y ausencia de lesión apical luego de los controles respectivos.
Palabras clave: Endodoncia, Ápice del Diente, Regeneración, Necrosis de la Pulpa Dental. (DeCS)
Summary
Regenerative endodontic procedures is being done in endodontics us as alternative option to traditional nonsurgical root canal treatment in cases with pulp necrosis in which the root development has not been completed at the time of the injury. In this case report we present two lower premolars in the same patient with Dens Evaginatus in wich we used a protocol based on the existing literature, including a lower concentration of NaOCl, 17% EDTA and a mixture of 3 antibiotics. After the treatment there was a complete healing including absence of symptoms, lengthening and thickening of the root, and absence of apical lesion in the control appointments.
Key words: Endodontics, Tooth Apex, Regeneration, Dental Pulp Necrosis.
Abstract
1 Residente de la Especialidad de Endodoncia de la Universidad Peruana Cayetano Heredia. 2 Especialista en Endodoncia de la Universidad Peruana Cayetano Heredia/ Docente Universidad Peruana Cayetano Heredia 3 Especialista en Endodoncia de la Universidad Peruana Cayetano Heredia/ Docente Universidad Peruana Cayetano Heredia/ Past Presidente de la Sociedad Peruana de Endodoncia.
Introdución
Un aspecto clave en el tratamiento de canales es la determinación de la longitud de trabajo1, para lo cual se debe contar con el desarrollo radicular completo. Las lesiones cariosas o traumáticas no esperarán que esto se haya dado, por lo que en casos de necrosis pulpar en donde no se haya completado el desarrollo del ápice se tendrá que ejecutar una alternativa de tratamiento diferente a la convencional. En los últimos años se viene realizando tratamientos regeneradores pulpares (TRP) como una de las alternativas más adecuadas para éstos casos, ya que este tratamiento no solo busca la desinfección y el cierre apical, como lo buscan los tratamientos de apexificación, sino que además se busca el engrosamiento y alargamiento radicular, obteniendo con esto una disminución del riesgo de complicaciones a largo plazo2. El objetivo de este estudio es presentar el manejo del TRP en casos de necrosis pulpar con presencia de Dens Evaginatus.
CASOS CLÍNICOS
Una paciente de sexo femenino de 12 años acudió al Servicio de Odontopediatría del Hospital de Essalud “Alberto Leopoldo Barton Thompson” (Callao-Perú) para la evaluación de dos segundos premolares inferiores. En la exploración clínica intraoral, dichas piezas dentarias estaban asintomáticas, sin caries, pero con presencia de Dens Evaginatus (Fig. 1). La niña presentó un tracto sinusal (fístula) en las piezas en evaluación (Fig.2). Fue derivada al servicio de Endodoncia para evaluación y manejo interdisciplinario del caso, lo que se asumió es que se fracturaron los tubérculos del esmalte durante la masticación y hubo una microexposición de las cámaras pulpares, las piezas dentarias presentaban los ápices abiertos asociados a lesiones periapicales (Fig. 3), se diagnosticó como necrosis pulpar y absceso periapical crónico según la AAE en ambas piezas dentarias.
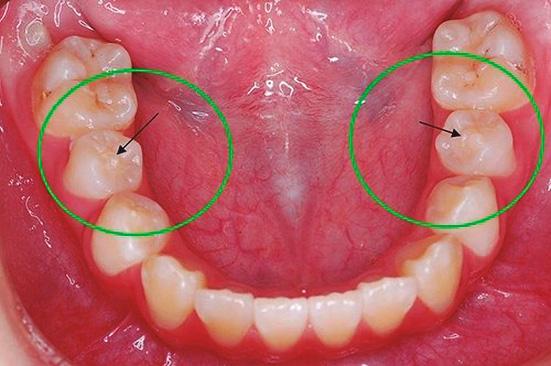
Fig. 1. Piezas 45 y 35 presencia de Dens Evaginatus.
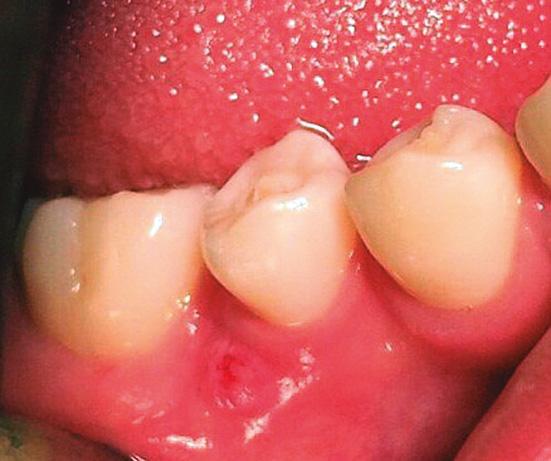
Fig. 2. Presencia de tracto sinusal con drenaje de material purulento.
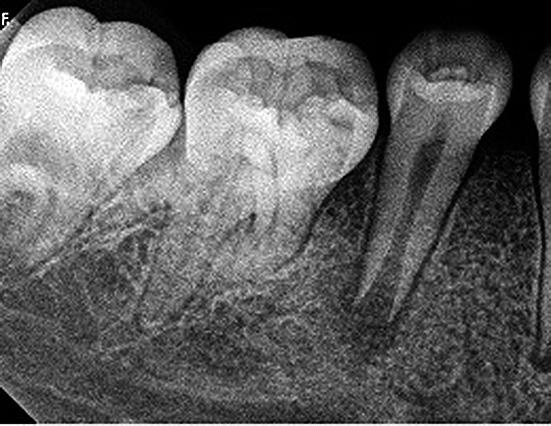
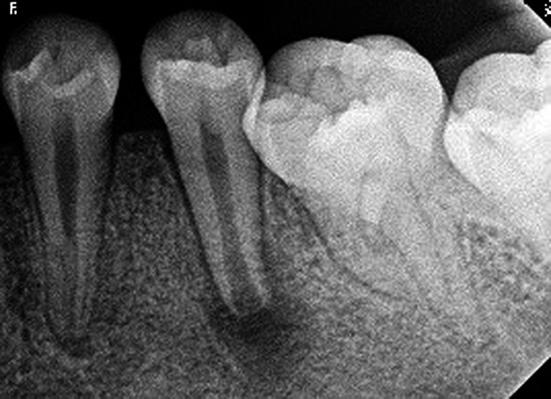
Fig. 3. Piezas 45 y 35 radiográficamente presentan ápices abiertos asociados a lesión periapical.
Las pruebas de sondaje periodontal estuvieron dentro de los parámetros normales. Las pruebas de vitalidad pulpar fueron negativas al frío, mientras que a la percusión y palpación resultaron normales. Se consideró el realizar el TRP en ambas piezas dentarias.
Se colocó anestesia y realizó el aislamiento absoluto, se preparó una cavidad de acceso por oclusal, observando un drenaje de material purulento con sangrado. Se realizó lavados lentos con NaOCl al 2.6%, suero fisiológico y EDTA al 17%. El canal fue secado con conos de papel estériles y se preparó una pasta triantibiótica de ciprofloxacino, metronidazol y minociclina mezclada con suero fisiológico. La cavidad de acceso se selló con ionómero de vidrio reforzado con resina (Fuji II LC, GC, Japón)
La paciente regresó 26 días después, asintomática, sin reportar dolor postoperatorio. El tracto sinusal desapareció, y hubo cierta reducción de la radiolucidez de la lesión (Fig. 4). Se colocó anestesia sin vasoconstrictor y se realizó el aislamiento absoluto, se desinfectó el canal con NaOCl al 2,6%, suero fisiológico y EDTA al 17%, los canales parecían limpios, sin signos de exudado inflamatorio. Se colocó un instrumento dentro de ellos hasta sobrepasar el límite del ápice para irritar el tejido apical y crear sangrado, que llegó hasta aproximadamente 3mm debajo del límite UCA. Se controló el sangrado por 15 minutos y se secó con conos de papel acondicionando el espacio y se colocó MTA sobre el coágulo de sangre, seguido de una bolita de algodón humedecida con suero fisiológico y ionómero.
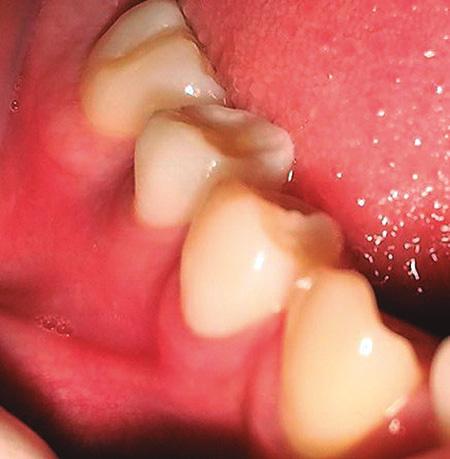
Fig. 4. Desaparición de tracto sinusal en pieza 45.
Dos semanas después, la paciente regresó asintomática, se retiró el material provisional y la bolita de algodón y se reemplazó con una restauración definitiva de resina (Filtek Z250,3M ESPE,EEUU).
El seguimiento fue realizado a los 3, 6, 9, 12, 17 y 24 meses posteriores al tratamiento. La paciente se encontró asintomática desde sus primeros controles. A los 12 meses presentó cambios a nivel radiográfico que se hicieron más evidentes a los 17 meses, ya que hubo alargamiento y grosor de la pared dentinaria a nivel apical (Fig. 5). En el control de los 24 meses se realizó un control a través de la tomografía computarizada cone beam (Galileos, Sirona, EEUU), comprobándose el alargamiento radicular y engrosamiento de las paredes dentinarias en una visión tridimensional, mejorando las imágenes obtenidas anteriormente con las radiografías periapicales (Fig. 6).
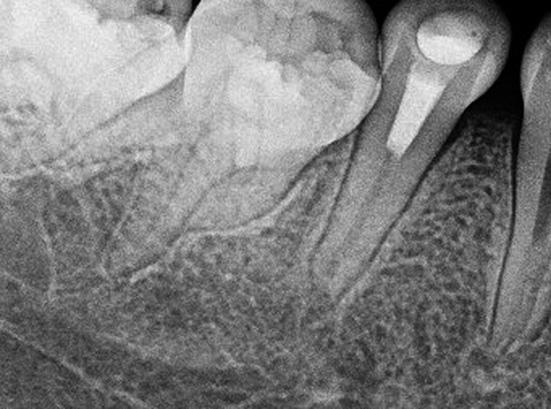
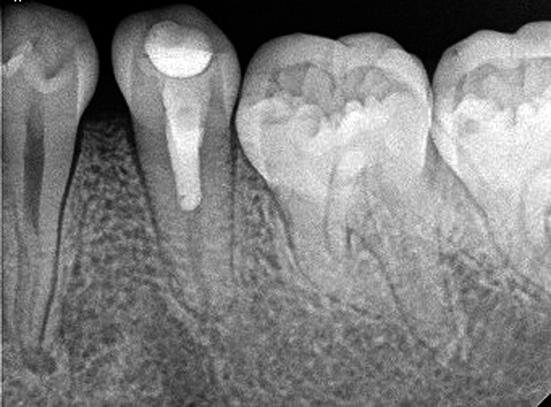
Fig. 5. Control a los 17 meses. Cambios en paredes dentinarias
Discusión
Los TRP se comenzaron a estudiar en los años 60 3, no obstante esta investigación se detuvo y no es sino a partir del año 2001 que se retoman los estudios en relación a estos tratamientos. Iwaya en el 2001 4 publica un reporte de caso de una paciente con diagnóstico de necrosis pulpar en un segundo premolar inferior, en el que luego de 30 meses de realizado el tratamiento se presenta el cierre apical completo y el engrosamiento de las paredes de la raíz. Tres años más tarde, Banch y Trope 5 presentan un protocolo más establecido convirtiéndose en el reporte de caso clave en este tipo de procedimientos. En este caso se muestra un segundo premolar inferior que, luego de la desinfección del canal radicular con antibióticos y una posterior inducción a la formación de un coágulo, es controlada durante 24 meses observándose un engrosamiento radicular y un cierre apical similar al de las piezas contralaterales al finalizar los controles.
La base biológica parece radicar en la presencia de células madre ubicadas a nivel apical de las piezas dentarias (SCAP). Estas células tienen el potencial de diferenciarse en células similares a odontoblastos y formar un complejo dentino pulpar 6. Por consecuencia, los TRP intentarán aprovechar la presencia de estas células a nivel apical, brindándoles el medio adecuado para que continúen la formación de tejido a nivel apical. Este medio consiste en un andamio, factores de crecimiento y un entorno prácticamente estéril 7. El andamio es una estructura que provee soporte para la organización, proliferación, diferenciación y revascularización celular, en el clínico esto se traduce en diferentes materiales como el coágulo sanguíneo, plasma rico en plaquetas, fibrina rica en plaquetas, coágulo sanguíneo más esponjas de colágeno, etc. 8,9 Por su parte, los factores de crecimiento son proteínas que se unen a receptores en las células y actúan como señales para inducir la proliferación y/o diferenciación celular. Mientras que el entorno estéril es el que en condiciones normales se encontraría en esta zona apical y el que, por lo tanto, intentaremos devolver con los procedimientos de desinfección y aplicación de medicación. Estos elementos junto con las células madre constituyen la tétrada para la ingeniería tisular descrita por Malhotra7.
El enfoque de tratamiento es descrito generalmente en dos citas de acuerdo al protocolo de Banch y Trope; según estos autores la segunda cita es a los 26 días de la primera 5. En general se reporta un promedio de 4 semanas entre una cita y otra 10. Sin embargo, dependiendo de las condiciones del paciente, se encuentran en la literatura tratamientos que van desde una semana después del primer procedimiento11 hasta luego de 25 meses después, contando siempre con controles del paciente cuando el tratamiento se vuelve prolongado 12.
La primera cita tiene como objetivo desinfectar los canales. En ésta se procede a anestesiar y a aislar de forma absoluta la pieza a tratar. Banch y Trope 5 para esta cita reportaron el uso de NaOCl en alta concentración (5.25%), además del uso de clorhexidina. Sin embargo, además de la desinfección se debe cuidar la permanencia y viabilidad de las células madre, en estudios posteriores se determinó que el NaOCl en altas concentraciones reduce dramáticamente dicha viabilidad de las SCAP, y que el uso de clorhexidina es perjudicial a éstas, no dejando células disponibles 13. Así mismo, se ha reportado que el NaOCl en bajas concentraciones (De 1 a 3%) favorece la supervivencia de células madre 14, motivo por lo que la AAE propone el uso de NaOCl al 1.5% 15. En el presente caso, por motivos de facilidad de mezcla se usó al 2.6% que vendría a ser NaOCl mezclado con suero fisiológico en proporción de 1:1.
Posteriormente se procede a secar los canales con puntas de papel y a aplicar algún medicamento que actúe en la desinfección hasta la siguiente cita. Dentro de los medicamentos más usados en la literatura están las pastas triantibióticas y biantibióticas que pueden incluir metronidazol, ciprofloxacino, minociclina, cefaclor o amoxicilina, además del uso de hidróxido de calcio10. Si bien es cierto éste último no es el más usado, Ruparel y col. demostraron que el hidróxido de calcio en comparación con las pastas antibióticas es el único que no propicia citotoxicidad a las células madre16. Por su parte Galler y col. sostienen que las pastas antibióticas también afectan a los factores de crecimiento17. Por lo que hacen falta mayores estudios al respecto ya que tanto el uso de las pastas antibióticas como el hidróxido de calcio poseen amplia literatura publicada que corrobora su efecto positivo en los TRP10. Posteriormente se dejará una restauración provisional que asegure el sellado hasta la siguiente cita.
Luego de este procedimiento es importante controlar la mejoría del paciente, en caso haya existido la presencia de tracto sinusal, éste debe desaparecer para el siguiente procedimiento, así como la sintomatología que se haya presentado previamente. En caso contrario se debe ir controlando hasta que haya una mejoría o ir cambiando la medicación antes de proceder con el segundo paso del tratamiento. Si a pesar de los recambios en la medicación la clínica no mejora entonces se deberá optar por otros tratamientos como por ejemplo la apexificación18.
Aproximadamente en 4 semanas10 se continuará con el tratamiento. En esta ocasión la anestesia a usar será una que no tenga vasoconstrictor pues en esta cita el objetivo es conseguir un sangrado que provenga de la zona apical hacia el canal radicular19. Para esto primero se procederá a remover los remanentes de la medicación del canal mediante la irrigación con NaOCl en bajas concentraciones y la adición de otro irrigante que es el EDTA al 17%. Galler17 determinó que la adición de EDTA luego del uso del NaOCl en los procedimientos de regeneración ayudaba a revertir los efectos negativos de éste y además favorecía la expresión de los factores de crecimiento, pieza clave en la regeneración. Después del secado con puntas de papel se provocará el sangrado introduciendo ya sea un explorador o una lima más allá del foramen apical abierto, el sangrado debe llegar hasta 3mm antes de la unión cemento-esmalte. Luego de esperar 15 minutos para que se forme un coágulo, en este nivel se introducirá MTA5. Seguidamente se puede colocar una torunda de algodón humedecida y sellar con un material provisional que será removido junto con el algodón en una siguiente cita a la semana para cambiar el material restaurador por uno definitivo.
No siempre es posible conseguir un sangrado apical que servirá como andamio, además que requiere tiempo y puede ser doloroso ya que el anestésico usado puede no proveer la eliminación completa del dolor 2. Es por eso que se han venido desarrollando alternativas al coágulo sanguíneo como son los andamios con células madre o factores de crecimiento que intentan mejorar el pronóstico de la regeneración 20,21.
Es necesario luego de culminar el tratamiento entrar en una etapa de control. La Asociación Americana de Endodoncia propone una guía para la evaluación de control, clínicamente el diente deberá permanecer asintomático y funcional; mientras que radiográficamente en la evaluación entre los 6 y 12 primeros meses se evaluará la resolución de la radiolucidez y el probable incremento del grosor en las paredes dentinarias, así como entre los 12 y 24 meses se observará además de un incremento en grosor, un incremento en longitud radicular 15.
Bukhari y col. en el 2016 presentaron un esquema de cómo evaluar el éxito de los TRP, determinando curación completa, incompleta y fracaso, dependiendo de tres variables: resolución de periodontitis apical, ausencia de signos y síntomas, y signos radiográficos de continuo desarrollo radicular. En una curación completa se cumplirán todas las variables, mientras que en la incompleta no se observará desarrollo radicular radiográficamente y en el fracaso no se cumplirán ninguna de las variables descritas 22. En base a este esquema, en el caso presentado las piezas dentarias mostrarían una curación completa luego del tratamiento.
Como podemos observar luego de 24 meses, el tratamiento elegido fue el correcto debido a que las piezas dentarias permanecieron sin sintomatología clínica, además de funcionales, y radiográficamente se evidenció mejoría en el cierre apical contando con un alargamiento y engrosamiento dentinario.
CASOS CLÍNICOS
En base a la reciente y cada vez mayor cantidad de literatura en relación a los TRP, se puede observar una evolución próspera, que no se limita a un determinado protocolo, sino que busca progresos en el resultado. Es así que el clínico no debería encasillarse en un solo enfoque, sino ir en busca de los más recientes avances en favor de nuestros pacientes, dado que este es un tratamiento que aún no lleva a un consenso estandarizado en sus procedimientos pero que ha conseguido algo que quizá muchos años atrás se veía como inimaginable.
Referencias Bibliográficas
1. Ricucci D. Apical limit of root canal instrumentation and obturation, part 1. Literature review. Int Endod J. 1998 Nov;31(6):384-93.
2. Galler KM. Clinical procedures for revitalization: current knowledge and considerations. Int Endod J. 2016 Oct;49(10):926-36.
3. Ostby BN. The role of the blood clot in endodontic therapy. An experimental histologic study. Acta Odontol Scand. 1961 Dec;19: 324-53.
4. Iwaya SI, Ikawa M, Kubota M. Revascularization of an immature permanent tooth with apical periodontitis and sinus tract. Dent Traumatol. 2001 Aug;17(4):185-7
5. Banchs F, Trope M. Revascularization of immature permanent teeth with apical periodontitis: new treatment protocol? J Endod. 2004 Apr;30(4):196-200.
6. Lee BN, Moon JW, Chang HS, Hwang IN, Oh WM, Hwang YC. A review of the regenerative endodontic treatment procedure. Restor Dent Endod. 2015 Aug;40(3):179-87.
7. Malhotra N, Mala K. Regenerative endodontics as a tissue engineering approach: past, current and future. Aust Endod J. 2012 Dec;38(3):137-48.
8. Nagy MM, Tawfik HE, Hashem AA, Abu-Seida AM. Regenerative potential of immature permanent teeth with necrotic pulps after different regenerative protocols. J Endod. 2014 Feb;40(2):192-8.
9. Torabinejad M, Nosrat A, Verma P, Udochukwu O. Regenerative Endodontic Treatment or Mineral Trioxide Aggregate Apical Plug in Teeth with Necrotic Pulps and Open Apices: A Systematic Review and Meta-analysis. J Endod. 2017 Nov;43(11):1806-1820.
10. Kontakiotis EG, Filippatos CG, Tzanetakis GN, Agrafioti A. Regenerative endodontic therapy: a data analysis of clinical protocols. J Endod. 2015 Feb;41(2):146-54.
11. Jung IY, Lee SJ, Hargreaves KM. Biologically based treatment of immature permanent teeth with pulpal necrosis: a case series. J Endod. 2008 Jul;34(7):876-87.
12. Chueh LH, Ho YC, Kuo TC, et al. Regenerative endodontic treatment for necrotic immature permanent teeth. J Endod 2009;35:160–4.
13. Trevino EG, Patwardhan AN, Henry MA, Perry G, Dybdal-Hargreaves N, Hargreaves KM, Diogenes A. Effect of irrigants on the survival of human stem cells of the apical papilla in a platelet-rich plasma scaffold in human root tips. J Endod. 2011 Aug;37(8):1109-15
14. Martin DE, De Almeida JF, Henry MA, Khaing ZZ, Schmidt CE, Teixeira FB, Diogenes A. Concentration-dependent effect of sodium hypochlorite on stem cells of apical papilla survival and differentiation. J Endod. 2014 Jan;40(1):51-5.
15. American Association of Endodontists. Regenerative endodontics. Disponible en: https://www.aae.org/specialty/wp-content/uploads/sites/2/2017/06/ecfespring2013.pdf Acceso 30 de marzo, 2018.
16. Ruparel NB, Teixeira FB, Ferraz CC, Diogenes A. Direct effect of intracanal medicaments on survival of stem cells of the apical papilla. J Endod. 2012 Oct;38(10):1372-5.
17. Galler KM, Buchalla W, Hiller KA, Federlin M, Eidt A, Schiefersteiner M, Schmalz G. Influence of root canal disinfectants on growth factor release from dentin. J Endod. 2015 Mar;41(3):363-8.
18. Huang GT. A paradigm shift in endodontic management of immature teeth: conservation of stem cells for regeneration. J Dent 2008;36:379–86.
19. Chan EK, Desmeules M, Cielecki M, Dabbagh B, Ferraz Dos Santos B. Longitudinal Cohort Study of Regenerative Endodontic Treatment for Immature Necrotic Permanent Teeth. J Endod. 2017 Mar;43(3):395-400.
20. Wang Y, Zhao Y, Jia W, Yang J, Ge L. Preliminary study on dental pulp stem cell-mediated pulp regeneration in canine immature permanent teeth. J Endod. 2013 Feb;39(2):195-201.
21. Altaii M, Kaidonis X, Koblar S, Cathro P, Richards L. Platelet rich plasma and dentine effect on sheep dental pulp cells regeneration/revitalization ability (in vitro). Aust Dent J. 2017 Mar;62(1):39-46.
BukhariS, KohliMR, SetzerF, KarabucakB. Outcome of Revascularization Procedure: A Retrospective Case Series. J Endod. 2016 Dec;42(12):1752-1759.







