Revista Canal Abierto 39 | Caso Clínico
Neuropatía dolorosa trigeminal postraumática como consecuencia de un tratamiento de canales radiculares: Reporte de caso.
Álvaro González-Villalobos 1,2
- Departamento de Rehabilitación Bucomaxilofacial, Unidad de Trastornos Temporomandibulares y Dolor Orofacial, Universidad de Talca, Talca, Chile.
- Centro de referencia de trastornos temporomandibulares y dolor orofacial, Universidad de Talca, Talca, Chile.
Resumen
Frente al relato de dolor orofacial, es necesario identificar y diferenciar el dolor nociceptivo del dolor neuropático. Este último es originado como consecuencia directa de una lesión o enfermedad que afecta al sistema nervioso somatosensorial. Para realizar su diagnóstico en la práctica clínica regularmente se realiza una completa anamnesis junto a un examen físico somatosensorial cualitativo, de fácil aplicación, con una buena sensibilidad y especificidad diagnóstica para dolor neuropático.
Se presenta el caso de una mujer de 43 años de edad que acude al Centro de Referencia de Trastornos Temporomandibulares y Dolor Orofacial de la Universidad de Talca, por dolor de tipo quemante y punzante en zona edéntula correspondiente a dientes 2.5 a 2.7 de 2 años de evolución. Intensidad EVA 8, frecuencia diaria, de 8 a 10 horas de duración. Iniciado 2 a 3 meses posterior al tratamiento del sistema de canales de diente 2.6. Relata múltiples procedimientos endodónticos que finalizaron en la exodoncia de dientes 2.4 a 2.8, los cuales no eliminaron el dolor, sino que lo agravaron. Al examen físico se detectó alodinia al roce e hiperalgesia al frío en zona afectada. En base a la anamnesis y exámenes realizados, se diagnosticó una Neuropatía Dolorosa Trigeminal Post Traumática (NDTPT). Se indicó lidocaína plastibase al 8% de uso tópico y pregabalina 150mg/día por un mes, no siendo suficiente para el manejo del dolor, por lo que se adicionó duloxetina 30mg/día. Al sexto mes relató EVA 2, con 1 a 2 crisis al mes de 1 a 2 horas de duración, lo cual se consideró exitoso.
Palabras claves: dolor neuropático, odontalgia atípica, neuropatía postraumática.
Summary
In the field of orofacial pain, is necessary to identify and differentiate nociceptive pain from neuropathic pain. The latter is caused as a direct result of an injury or disease that affects the somatosensory nervous system. In order to achieve a diagnosis a complete anamnesis is performed, which is complemented by a qualitative somatosensory physical examination, that is easy to apply, with good sensitivity and specificity for neuropathic pain.
A 43-year-old female patient attended the Center for Temporomandibular Disorders and Orofacial Pain of the University of Talca, because of burning and puncture pain in the edentulous zone corresponding to teeth 2.5 to 2.7 with a 2-year history. Intensity VAS 8, daily frequency, from 8 to 10 hrs. Initiated 2 to 3 months after root canal treatment on tooth 2.6. Patient reports multiple endodontic procedures that ended in the extraction of teeth 2.4 to 2.8 which did not eliminate the pain but worsened it. Physical examination revealed mechanical allodynia and cold hyperalgesia in the painful area. Based on the anamnesis and tests performed, a Painful Posttraumatic Trigeminal Neuropathy (PPTN) was diagnosed. Lidocaine 8% and pregabalin 150mg/day were indicated for one month, but not being sufficient for pain management, so duloxetine 30mg/day was added. In the sixth month control she reported VAS 2, with 1 to 2 episodes per month from 1 to 2 hours, which was considered successful. It is important in orofacial pain to recognize PPTN as a differential diagnosis of other pain of odontogenic origin, so it is very important to achieve a correct anamnesis and complementary examinations. Otherwise, we could indicate treatments that end in loss of pulp vitality or multiple extractions.
Key words: Neuropathic pain, atypical odontalgia, posttraumatic neuropathies.
Abstract
Departamento de Rehabilitación Bucomaxilofacial, Unidad de Trastornos Temporomandibulares y Dolor Orofacial, Universidad de Talca, Talca, Chile. Centro de referencia de trastornos temporomandibulares y dolor orofacial, Universidad de Talca, Talca, Chile.
Introdución
El dolor dentoalveolar persistente (mayor a 6 meses) posterior a algún tipo de tratamiento de endodoncia, no es una condición extraña, ya que se ha estimado en un meta-análisis que se presenta en el 5,3% de lo casos (1). Sin embargo debemos considerar que el dolor referido a un diente no necesariamente se origina desde la pulpa o el tejido perirradicular, en tal caso nos encontraremos ante una odontalgia de origen no odontogénico (2). Este tipo de dolor representa el 56% del dolor persistente postendodóntico (1), pudiendo presentarse por dolor referido de un cuadro miofascial, cefalea, neuropatías y otros dolores derivados de diversas patologías (3)(4).
Tabla 1. Criterios diagnósticos para la neuropatía dolorosa trigeminal postraumática propuestos por tercera clasificación internacional de cefaleas (6).
| A. Dolor facial y/u oral en la distribución de uno o ambos nervio(s)trigémino(s) y que cumple con el criterio C. |
| B. Antecedentes de un evento traumático identificable en el nervio trigémino, con signos clínicamente evidentes, ya sean positivos (hiperalgesia, alodinia) y/o negativos (hipoestesia, hipoalgesia) de disfunción del nervio trigémino. |
| C. La causalidad queda demostrada mediante los dos criterios siguientes: 1. El dolor se localiza en la distribución de la misma rama del nervio trigémino afectado por el evento traumático. 2. El dolor se manifiesta dentro de los primeros 6 meses posteriores al evento traumático. |
| D. Sin mejor explicación por otro diagnóstico de la ICHD. |
A. Dolor facial y/u oral en la distribución de uno o ambos nervio(s) trigémino(s) y que cumple con el criterio C.
B. Antecedentes de un evento traumático identificable en el nervio trigémino, con signos clínicamente evidentes, ya sean positivos (hiperalgesia, alodinia) y/o negativos (hipoestesia, hipoalgesia) de disfunción del nervio trigémino.
C. La causalidad queda demostrada mediante los dos criterios siguientes:
1. El dolor se localiza en la distribución de la misma rama del nervio trigémino afectado por el evento traumático.
2. El dolor se manifiesta dentro de los primeros 6 meses posteriores al evento traumático.
D. Sin mejor explicación por otro diagnóstico de la ICHD.
Dentro de los cuadros de dolor neuropático más comunes que pudieran presentar dolor dentario, se encuentran la neuralgia trigeminal y la neuropatía dolorosa trigeminal postraumática (NDTPT), entre otros (5). Este último es el término más reciente propuesto por la Tercera Clasificación Internacional de Cefaleas en su versión final y en la cual se describen sus criterios diagnósticos (Tabla1) (6). Este cuadro viene a reemplazar ciertos términos como dolor por desaferentación, neuropatía traumática, dolor fantasma y en parte la odontalgia atípica (7).
Las neuropatías postraumáticas extraorales, en general tienen una presentación sencilla de pesquisar con una clara historia de trauma y alteración sensitiva, sin embargo, las presentaciones intraorales a menudo no se asocian con un evento traumático claramente descrito, ya que estos por lo general son parte de la terapéutica común del odontólogo. Pese a estas diferencias, la sintomatología y el tratamiento son similares (5) (8) (9).
La NDTPT se describe como un dolor facial u oral unilateral, que respeta la línea media, se presenta principalmente en mujeres, su inicio aparece entre los 40 a 50 años y afecta principalmente a premolares y molares superiores. El dolor puede ser espontáneo o evocado al tacto, frío o calor, que varía de moderado a severo y usualmente es descrito como un dolor quemante o punzante, pero puede presentar otras características (eléctricas, opresivas) (7). El dolor en la NDTPT intraoral, por lo general se presenta localizado al diente, mucosa adyacente o la zona desdentada que originó el cuadro, pero la zona dolorosa puede desplazarse de diente en diente, lo que conlleva muchas veces a sobre indicación de tratamientos dentales (9)(11). Una característica importante de la NDTPT es que la zona afectada presenta alteraciones somato sensitivas con síntomas positivos y/o negativos de disfunción del nervio trigémino como hiperalgesia, hipoestesia, alodinia, etc (7) (12). La detección de estos síntomas puede realizarse mediante un examen clínico básico, sin embargo en algunas ocasiones solo pueden ser detectadas mediante pruebas de sensibilidad más sofisticadas como el test sensitivo cuantitativo (5) (10) (13).
Es frecuente que los pacientes con NDTPT relaten múltiples y repetidas visitas a distintos especialistas, con tratamientos que se aplican en reiteradas ocasiones, terminando en la exodoncia de los dientes y en el agravamiento de los síntomas (14). Esto genera una complicación mayor para un correcto diagnóstico y tratamiento, ya que muchos de estos pacientes conllevan cuadros psicológicos,
como trastornos del ánimo o trastornos ansiosos (15). De hecho, hace algunos años muchos de estos cuadros fueron diagnosticados como dolor de origen psicogénico (17), algo que actualmente no está soportado por la evidencia científica (7).
El objetivo del presente reporte de caso es dar a conocer una entidad de dolor neuropático postraumático intraoral, que pese a ser poco frecuente, puede ser confundido con un cuadro de origen dentario llevando al Endodoncista a sobre indicar tratamientos en dientes cuyo manejo es principalmente farmacológico.
PRESENTACIÓN DEL CASO:
Presentamos el caso de una mujer de 43 años de edad que acude al Centro de Referencia de Trastornos Temporomandibulares y Dolor Orofacial de la Universidad de Talca, por dolor espontáneo y evocado frente a estímulos mecánicos y térmicos de tipo punzante y quemante en zona edéntula correspondiente a zona de dientes 2.5 a 2.7 de 2 años de evolución. Intensidad promedio de 8 sobre una escala visual análoga (EVA) de 10 máximo, frecuencia diaria, de 8 a 10 horas de duración y cuyo inicio se desarrolló 2 a 3 meses posterior a tratamiento del sistema de canales radiculares de diente 2.6. Inicialmente recibió tratamiento con analgésicos, antiinflamatorios y múltiples procedimientos endodónticos que finalizaron en la exodoncia progresiva de dientes 2,4 a 2,8 debido a que ningún tratamiento pudo controlar el dolor.
Al examen intraoral se observó una mucosa sin alteraciones o lesiones que justificaran la presencia de dolor (Fig. 1). Además al evaluar la radiografía panorámica, tampoco se observaron restos radiculares u otras lesiones óseas (Fig. 2). El examen físico descartó origen de dolor proveniente de otros dientes o estructuras como músculos, atm, etc. Ante el relato de dolor posterior al tratamiento de conductos y dolor quemante se sospechó de dolor neuropático postraumático, por lo que se hicieron las pruebas clínicas sensitivas de rigor como el test sensitivo cualitativo o QualST por su sigla en inglés (7). Esta consistió en evaluar primero la zona sin dolor como control y luego la zona dolorosa contralateral buscando la presencia de alteraciones sensitivas mediante 3 estímulos, tacto, punción y frío. Estas pruebas dieron como resultado alodinia al roce e hiperalgesia al frío en mucosa de zona afectada. Posteriormente se realizó un bloqueo anestésico diagnóstico con técnica infiltrativa, dando como resultado alivio del dolor. En base a la anamnesis y exámenes realizados, se diagnosticó una Neuropatía Dolorosa Trigeminal Post Traumática.
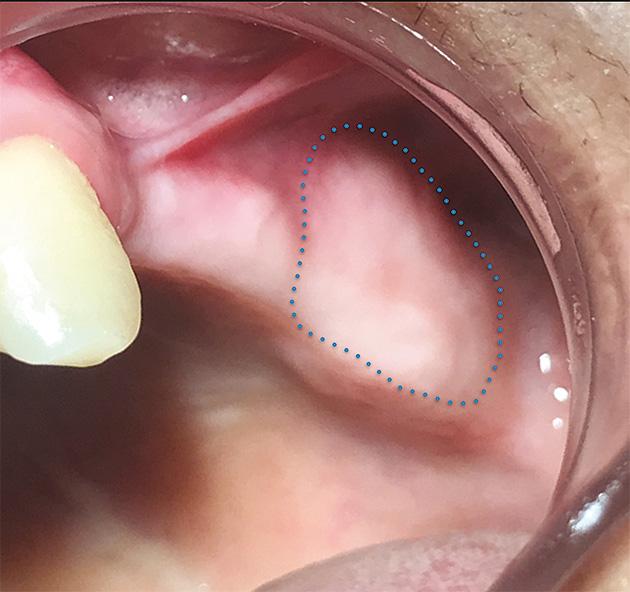
Figura 1. Vista intraoral de la zona afectada.
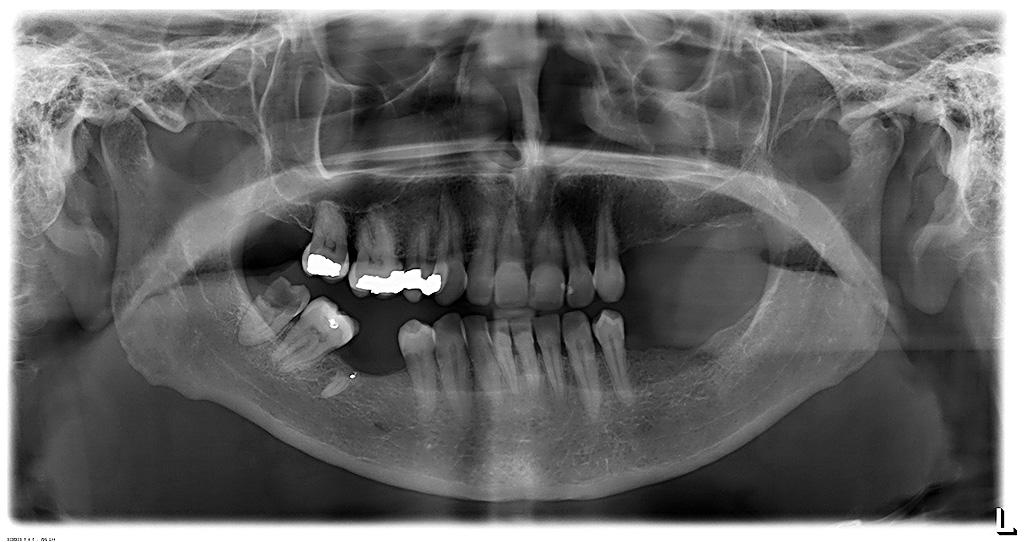
Figura 2. Radiografía panorámica.
Se decide comenzar el tratamiento con pregabalina (Lyrica®, Laboratorio Pfizer, Nueva York, USA) con dosis creciente hasta llegar a los 75mg cada 12 horas y aplicación tópica por 12 horas de lidocaína plastibase al 8% (recetario magistral) sobre un dispositivo intraoral estampado flexible de 2mm de espesor (Erkoflex®, Erkodent®, Alemania) por 30 días (Fig. 3) (Fig. 4) (Fig. 5). Al completar un mes de tratamiento se observó una disminución del dolor a una intensidad EVA 5 promedio y frecuencia de 4 a 6 días a la semana, no siendo suficiente para el manejo del dolor, por lo que se adicionó duloxetina (Duceten®, Laboratorio Abbott, Chicago, USA) de 30mg 1 vez al día.
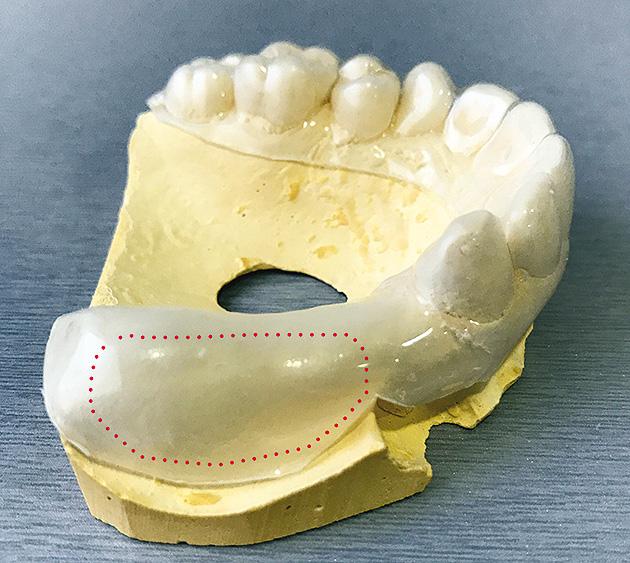
Figura 3. Estampado flexible y zona espaciada
demarcada para contención de lidocaína plastibase.
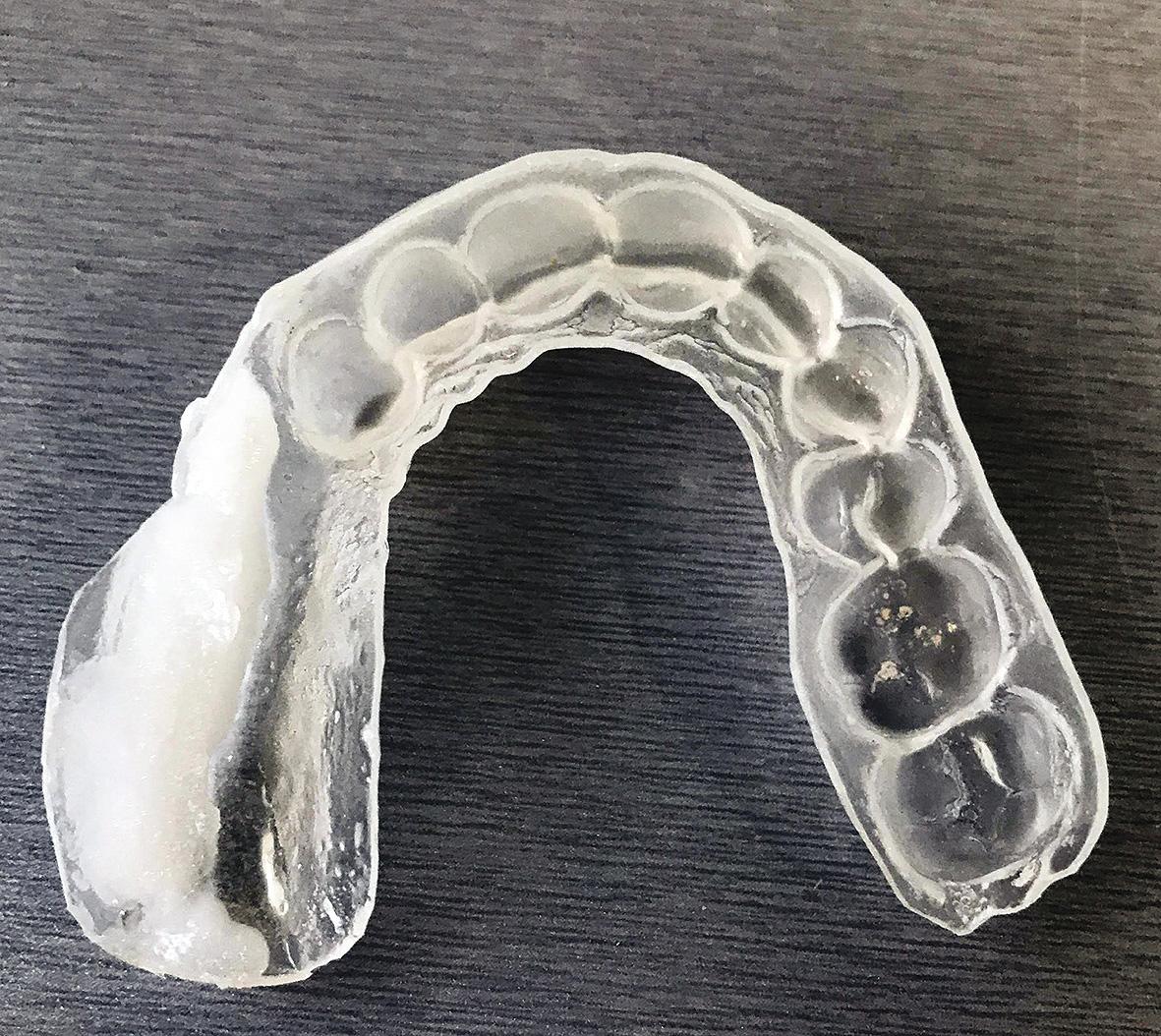
Figura 4. Dispositivo con lidocaína al 8%
plastibase en el dispositivo intraoral.
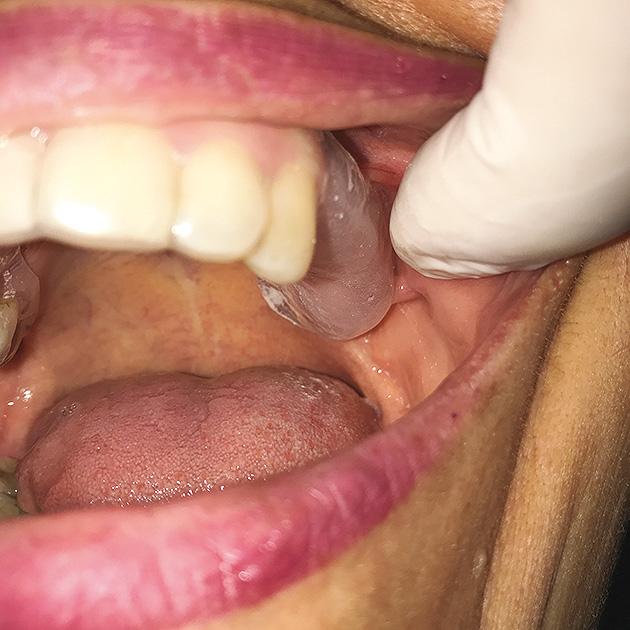
Figura 5. Vista del dispositivo intraoral en boca.
Se mantuvo un seguimiento por un periodo de 9 meses, presentándose episodios de dolor leve (EVA: 2), aislados 1 a 2 veces al mes, de 1 a 2 horas de duración, lo cual fue considerado exitoso por parte de la paciente.
Discusión
El caso presentado muestra la importancia de reconocer la NDTPT como diagnóstico diferencial del dolor de origen odontogénico y no odontogénico. Para esto, es vital realizar una correcta anamnesis y examen físico; de lo contrario, podríamos indicar tratamientos que terminen en la pérdida de la vitalidad pulpar o exodoncias. Esto ocurre debido a que la gran mayoría de la comunidad odontológica desconoce la NDTPT y las neuropatías en general, principalmente por su baja prevalencia (7). Lo anterior justifica que el Especialista en Endodoncia deba tener una mayor formación en dolor orofacial con el fin de mejorar la precisión diagnóstica y derivación oportuna al especialista en TTM y dolor orofacial.
La NDTPT puede resultar debido a una amplia variedad de lesiones nerviosas, desde la desaferentación completa de la fibra nerviosa o “neurotmesis”, hasta la lesión parcial del axón (axonotmesis) o de la vaina de mielina (neuropraxia), donde se preserva parte de la fibra nerviosa. Por lo tanto, cualquier tratamiento odontológico que genere una lesión neural potencialmente podría provocar una NDTPT (7). Esto es muy importante, ya que el endodoncista debe considerar que la biopulpectomía per se conlleva una lesión neural del paquete nervioso a nivel de la constricción apical, sin considerar las lesiones que generan daño neural periapical, por instrumentación o lesiones químicas por proyección de desinfectantes o material de obturación. Además de estas se encuentran las cirugías apicales, e incluso la técnica anestésica troncular a la língula, que puede generar daño parcial mecánico y/o químico por neuropraxia del nervio dentario inferior o lingual (17). Además, el tipo de anestésico local a utilizar también podría influir, ya que se ha descrito que la articaína al 4% puede ser neurotóxico y por esto no se recomienda en técnicas tronculares (18), (21).
Una vez generada la lesión neural, comienza un proceso de reparación que generalmente tiene buen pronóstico y termina con la cicatrización completa del tejido nervioso, recuperándose la capacidad sensitiva de manera parcial o total, proceso que puede durar de semanas a 18 meses. Sin embargo, en algunos casos se genera una serie de eventos que llevan a la aparición de dolor neuropático (7).
Dentro de los mecanismos fisiopatológicos que explican el origen del dolor neuropático posterior a una lesión neuronal, se encuentran fenómenos que ocurren tanto a nivel periférico como central. El primero de ellos es la Sensibilización Periférica, que comúnmente resulta de la inflamación de los tejidos neurales remanentes, que genera disminución patológica de umbral doloroso (hiperalgesia), además de dolor espontáneo por Descargas Ectópicas por hiperactividad de canales iónicos debido a la inflamación neural. Existen también Interacciones Patológicas entre Fibras, donde fibras Aβ de tacto pueden excitar directamente a neuronas que conducen dolor y Cambios Fenotípicos en fibras Aβ que expresan sustancia P. Estos fenómenos asociados a fibra Aβ pueden explicar la presencia de dolor al tacto o roce (alodinia) durante el examen físico (18).
Por su parte, la Sensibilización Central se puede presentar rápidamente debido a estímulos nociceptivos de alta intensidad y frecuencia provenientes de la primera neurona, generando una hiperexcitabilidad y descenso patológico del umbral de la neurona de segundo orden ubicada en el núcleo espinal de trigémino, manifestándose como hiperalgesia y dolor espontáneo. Estos fenómenos además amplían el campo receptivo neuronal, percibiéndose dolor en áreas donde no hay un nervio afectado (hiperalgesia secundaria), se produce expresión y transcripción génica, que alteran los mecanismos analgésicos propios de nuestro cuerpo, disminuyéndose nuestra capacidad para controlar el dolor. Si se produce muerte neuronal tras la lesión, la eliminación de las fibras dañadas en el núcleo trigeminal permite que las fibras Aβ las invadan, aumentando la alodinia. La muerte celular también puede afectar a las interneuronas inhibitorias que normalmente controlan el dolor, aumentando la facilitación de los estímulos dolorosos. Por último, dentro de los mecanismos centrales las Células Gliales juegan un rol importante, ya que estas son capaces de liberar moléculas excitatorias, aumentando la hiperexcitabilidad ya establecida. Esta gran variada fisiopatología pone al descubierto los complejos fenómenos involucrados en la génesis del dolor neuropático postraumático y explica por qué los antiinflamatorios no esteroidales no son suficientes para manejar el dolor (18).
Todos estos cambios ya sean periféricos o centrales explican las manifestaciones clínicas, incluyendo los síntomas positivos y/o negativos del sistema somatosensorial. Uno de los exámenes físicos que debiera ser manejo de los endodoncistas es el test sensitivo cualitativo (13). Este es un screening, fácil de aplicar en el sillón de procedimientos, y que consiste en pruebas de sensibilidad de la mucosa adyacente al diente o zona desdentada dolorosa. Al igual que en el test de sensibilidad pulpar, primero se estimula la zona control y posteriormente la zona a examinar. Dentro de los estímulos más utilizados se encuentran el roce, la punción y el frío.
Para evaluar la respuesta al roce se utiliza una motita de algodón o un cotón que se desliza por la mucosa de la zona control, abarcando entre 1 a 2 cm; posteriormente se repite en la zona dolorosa. Un test alterado se observa cuando se describe dolor al roce (alodinia) o menor sensación táctil (hipoestesia) en la zona afectada. El estímulo frío se aplica mediante un instrumento metálico como una espátula de cemento o una espátula de cera expuesta a agua fría a 0º celcius por un 1 a 2 segundos. Un test alterado se observa cuando se describe mayor percepción al frío, sea este doloroso o no (hiperestesia) o menor percepción de frío (hipoestesia) o frío doloroso (termohipoalgesia). El estímulo de punción se aplica mediante una sonda de caries con intensidad suficiente para provocar dolor sin penetrar la mucosa por no más de 1 segundo. Un test alterado se observa cuando el paciente describe una respuesta exagerada al dolor en la zona afectada (hiperalgesia) o ausencia de percepción de dolor (hipoalgesia). Este último test tiene la desventaja de ser muy dependiente de la presión aplicada, por lo que la experiencia del clínico puede ser importante (13).
El tratamiento de la NDTPT es principalmente farmacológico, donde el objetivo es poder intervenir en la mayor cantidad de procesos que modulan el dolor, tanto a nivel periférico como central (7). Actuar de manera temprana y oportuna es vital para evitar la cronificación del dolor, por lo que el manejo temprano de esta patología debiera estar orientado a controlar el grado de inflamación neuronal mediante el uso de corticoesteroides como la prednisona. Sin embargo, en cuadros avanzados de dolor crónico su eficiencia es muy baja (19).
El uso de anestésicos tópicos en la mucosa oral puede ser útil debido a que es capaz de bloquear canales de sodio controlando el dolor (20). En el presente caso, se indicó plastibase de lidocaina al 8% y se confeccionó un dispositivo intraoral estampado pre espaciado con el fin de contener el material en la zona dolorosa y evitar su propagación al resto de la cavidad oral y la faringe (7). En general, los anestésicos tópicos son insuficientes, por lo que el uso de fármacos a nivel central son útiles. Dentro de ellos se encuentra los antidepresivos tricíclicos, inhibidores selectivos de la recaptación de serotonina (ISRS), anticonvulsivantes, opiodes y otros (7).
Los antidepresivos tricíclicos, como la amitriptilina, se encuentran dentro de los fármacos de primera línea en el manejo de dolor neuropático, sin embargo, debido a sus efectos secundarios muchas veces se indican otras opciones. En el caso presentado se indicó pregabalina en dosis de 150mg día, el cual actúa bloqueando los canales de calcio, disminuyendo la liberación de neuropéptidos como la sustancia P y el glutamato limitando la sensibilización de la vía del dolor. Como el dolor no fue controlado de manera exitosa, se adicionó duloxetina en dosis de 30mg día. Este fármaco posee un efecto inhibidor de la recaptación de serotonina y noradrenalina, lo que permite potenciar a nivel central los tractos inhibitorios descendentes, generando analgesia. Este esquema farmacológico se basa en las recomendaciones internacionales y nacionales para el manejo del dolor neuropático (12).
El presente caso deja de manifiesto que el diagnóstico en dolor orofacial es todo un desafío y que el especialista en TTM y dolor orofacial puede ser un gran aliado del endodoncista. Sin embargo, este último puede cumplir un rol fundamental, ya que es uno de los primeros profesionales que se puede enfrentar a estos cuadros y facilitar una derivación oportuna. Por lo tanto, debería aumentar su conocimiento en el área, sobretodo en aquellas patologías que pueden presentarse como dolor dentario, pero de origen no odontogénico, como el dolor neuropático posterior a la terapia endodóntica. Esto es vital, ya que podrá evitar tratamientos que no solo no tendrán éxito, sino que pueden empeorar el cuadro terminando en la perdida de múltiples dientes.
Referencias Bibliográficas
1. Nixdorf DR, Moana-Filho EJ, Law AS, McGuire LA, Hodges JS, John MT. Frequency of persestent tooth pain following root canal therapy: A systematic review and meta-analysis. J Endod, 2010; 36(2): 224-230.
2. Mattscheck, D.; Law, AS.; Nixdorf, DR. Diagnosis of non-odonogentic toothache. In: Hargreaves, KM.; Cohen, S., Editors. Cohen’s pathways of the pulp. 10. St. Louis, MO: Mosby Inc; 2011. p. 49-70.
3. Nixdorf DR, Moana-Filho EJ, Law AS, et al. Frequency of nonodontogenic pain after endodontic therapy: A systematic review and meta-analysis. J Endod 2010; 36: 1494–1498.
4. Linn J, Trantor I, Teo N, Thanigaivel R, Goss AN. The differential diagnosis of toothache from other orofacial pains in clinical practice. Aust Dent J 2007;52:S100.
5. Baad-Hansen L, Pigg M, Ivanovic SE, et al. Intraoral somatosensory abnormalities in patients with atypical odontalgia – a controlled multicenter quantitative sen- sory testing study. Pain 2013; 154:1287–1294.
6. Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders, 3rd edition (final version). Cephalalgia 2018; 38(1):1–121.
7. Lene Baad-Hansen and Rafael Benoliel. Neuropathic orofacial pain: Facts and fiction. Cephalalgia. 2017; 37(7): 670–679.
8. Benoliel R, Birenboim R, Regev E, et al. Neurosensory changes in the infraorbital nerve following zygomatic fractures. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99: 657–665.
9. Forssell H, Ja ̈ a ̈ skela ̈ inen S, List T, et al. An update on pathophysiological mechanisms related to idiopathic orofacial pain conditions with implications for management. J Oral Rehabil 2014; 42:300–322.
10. Ja ̈ a ̈ skela ̈ inen SK, Teerijoki-Oksa T and Forssell H. Neurophysiologic and quantitative sensory testing in the diagnosis of trigeminal neuropathy and neuropathic pain. Pain 2005; 117:349–357.
11. Rafael B, Eli E. Neuropathic orofacial pain. Oral Maxillofac Surg Clin North Am 2008; 20:237–254.
12. Fernández R, Ahumada M, Muñoz R, Urra X, Yáñez M, Velasco M, Aguayo C, Bilbeny N, Correa G, Flores C, Rabah E, Jaque J, Sánchez P, Ortiz L, Orellana M, Pakuts A, Muñoz E, Ritter P, Orellana M, Mora X. Guía para Definición y Manejo del Dolor Neuropático Localizado (DNL): Consenso Chileno. Revista El Dolor 2011; 55:12-31.
13. Baad-Hansen L, Pigg M, Ivanovic SE, et al. Chairside intraoral qualitative somatosensory testing: Reliability and comparison between patients with atypical odontal- gia and healthy controls. J Orofac Pain 2013; 27: 165–170.
14. Haviv Y, Zadik Y, Sharav Y, et al. Painful traumatic trigeminal neuropathy: An open study on the pharma- cotherapeutic response to stepped treatment. J Oral Facial Pain Headache 2014; 28:52–60.
15. Baad-Hansen L, Leijon G, Svensson P, et al. Comparison of clinical findings and psychosocial factors in patients with atypical odontalgia and temporomandibular disorders. J Orofac Pain 2008; 22:7–14.
16. Brooke RI. Atypical odontalgia. A report of twenty-two cases. Oral Surg Oral Med Oral Pathol 1980; 49:196–199.
17. SMITH M., LUNG K. Nerve Injuries after Dental Injection: A Review of the Literature. J Can Dent Assoc 2006; 72(6):559-564.
18. Benoliel R, Sorin T, Eli E. Painful Traumatic Trigeminal Neuropathy. Oral Maxillofac Surg Clin N Am. 2016; 28(3):371–80.
19. Han SR, Yeo SP, Lee MK, et al. Early dexamethasone relieves trigeminal neuropathic pain. J Dent Res 2010; 89:915–920.
20. Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH, Gilron I. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015 Feb;14(2):162-73.
21.Hillerup S, Jensen RH, Ersboll BK. Trigeminal nerve injury associated with injection of local anesthetics: needle lesion or neurotoxicity? J Am Dent Assoc 2011;142:531–9.