Revista Canal Abierto 40 | Artículo Científico
Distribución espacial en el canal radicular del coágulo y de la membrana obtenida de fibrina rica en plaquetas.
Aceptado: 26-07-2019
Páginas 4-9
Vanessa Pérez B.. 1 Carolina Inostroza S. 1 Nicole Saint Jean N. 1 Claudia Brizuela C. 1
- Facultad de Odontología, Universidad de Los Andes. Mons. Álvaro del Portillo 12.455. Las Condes, Santiago, Chile. Phone: +56-2 2 618 11 66.
Resumen
Uno de los mayores desafíos de la práctica endodóntica es la restauración de los tejidos que se han perdido por enfermedades de la pulpa o patologías periapicales. En este escenario, los procedimientos de endodoncia regenerativa aparecen como nuevas opciones de tratamiento. La ingeniería de tejidos en endodoncia reemplaza parcial o totalmente el tejido perdido y regenera el complejo pulpa-dentina. Esto es posible utilizando células madre mesenquimales, andamios y factores bioactivos. El objetivo de esta investigación es comparar la distribución espacial en el canal radicular del coágulo y la membrana obtenida de la fibrina rica en plaquetas (PRF). Para este propósito, se diseñó un modelo de diente in vitro. Este modelo correspondió a 30 dientes unirradiculares previamente instrumentados con un diámetro apical de 1.5 mm. El PRF se obtuvo mediante el protocolo de Choukroun y se llevó el coágulo y la membrana al canal radicular de los dientes instrumentados. Posteriormente, se realizaron cortes en sección longitudinal y se evaluó la distribución espacial de los andamiajes en el canal radicular mediante microscopía óptica. El análisis estadístico de la distribución de los andamios se realizó mediante el programa STATA 13.
En esta investigación podemos concluir que no hubo diferencias en la distribución espacial entre el coágulo y la membrana de PRF al interior del canal radicular. El uso de los andamiajes de PRF podría ser una alternativa apropiada para ser considerada en los procedimientos de endodoncia regenerativa.
Palabras claves: Fibrina rica en plaquetas; Regeneración Pulpar; Andamiajes.
Summary
One of the greatest challenges of endodontic practice is the restoration of tissues that have been lost due to pulp diseases or periapical pathologies. In this scenario, the procedures of regenerative endodontics appear as new treatment options. Tissue engineering in endodontics partially or totally replaces lost tissue and regenerates the pulp-dentine complex. This is possible using mesenchymal stem cells, scaffolds, and bioactive factors. The objective of this research is to compare the spatial distribution in the root canal of the clot and the membrane obtained from platelet-rich fibrin (PRF). For this purpose, an in vitro tooth model was designed. This model corresponded to 30 uniradicular teeth previously instrumented with an apical diameter of 1.5 mm. The PRF was obtained by the Choukroun`s protocol and the clot and membrane were injected into the root canal of the instrumented teeth. Subsequently, teeth sections were cut longitudinally and the scaffolds spatial distribution was evaluated by optical microscopy. The statistical analysis of the scaffolds distribution was carried out through the STATA 13 program.
In this investigation we can conclude that there was no difference in the spatial distribution between the clot and the PRF membrane inside the root canal. The use of PRF scaffolds could be an appropriate alternative to be considered in regenerative endodontic procedures.
Key words: Platelet-Rich Fibrin; Pulp Regeneration; Tissue Scaffolds
Introdución
Los procedimientos de endodoncia regenerativa (del inglés regenerative endodontic procedures, REP) conecta tres elementos principales, las células madre, los factores de crecimiento y andamiajes (1,2). Las células madre son una herramienta prometedora para la regeneración de tejidos, debido a sus propiedades de proliferación, diferenciación, inmunomodulación y plasticidad celular (3). Otro aspecto clave en regeneración son los andamiajes, que deben proporcionar un micro ambiente con propiedades físico-químicas y biológicas, que imiten la matriz extracelular, permitiendo una función óptima de nutrición, adhesión, proliferación y señalización celular. Este objetivo es posible incorporando células y factores de crecimiento en el biomaterial tridimensional, que permita la proliferación y diferenciación celular, cuyo resultado será el desarrollo de un tejido funcional normal (4,5).
La fibrina rica en plaquetas (del inglés platelet-rich fibrin, PRF) es un concentrado de plaquetas de segunda generación desarrollado por Choukroun et al en Francia el año 2001. PRF es definido como un biomaterial autólogo compuesto por glóbulos blancos y plasma enriquecido con fibrina rica en plaquetas, que se ha utilizado ampliamente para acelerar la curación de tejidos blandos y biomineralizados en diferentes campos de la odontología (6–8).
El uso de derivados plaquetarios como andamiaje, presenta dos formas de manipulación; una de ellas es el coágulo y la otra es la membrana. El coágulo de PRF se obtiene inmediatamente después del proceso de centrifugación y se caracteriza por su consistencia amorfa y gelatinosa. La membrana de PRF se obtiene al comprimir el coágulo y eliminar los exudados, resultando una membrana rígida y densa más resistente que el coágulo (9,10).
Actualmente, una mayor comprensión con respecto al uso de concentrados de plaquetas autólogos (del inglés Autologous Platelets Concentrate, APC) y su papel en los procesos de curación, ha llevado al desarrollo de nuevos enfoques, en diferentes campos de la odontología. En particular, la fibrina rica en plaquetas y leucocitos (del inglés Leucocyte-rich platelet-rich fibrin, L-PRF) tiene varias propiedades que podrían ser muy favorables para los REP, incluída su capacidad para actuar como andamiaje y proporcionar factores de crecimiento, factores quimio tácticos y células (11).
En la última década, se ha estudiado PRF para el cultivo celular tanto in vitro como in vivo, lo que sostiene que es útil como andamio reabsorbible. Sin embargo, se necesitan estudios adicionales para apoyar su uso clínico (12,13).
Encontrar el andamiaje ideal implica un desafío, particularmente en endodoncia regenerativa, debido a la anatomía única y compleja del sistema de canales radiculares al interior del diente. Idealmente el andamiaje debe ser inyectable y adaptable y rellenar completamente los canales radiculares, especialmente en el tercio apical, para funcionar como un soporte estructural para las células madre de la región apical, posiblemente de la papila apical (del inglés stem cells apical papilla, SCAP) (14). Al mismo tiempo, se ha descrito que en la regeneración de tejidos, el tamaño del tejido regenerado es proporcional al andamiaje utilizado (15,16).
Por lo tanto, el objetivo de este estudio fue comparar la distribución espacial en el canal radicular del coágulo y de la membrana obtenida del PRF en un modelo de diente in vitro. A la fecha de esta investigación no hay evidencia científica en la que se compare la distribución espacial de coágulos y membranas de PRF en el canal radicular.
Materiales y Métodos
El diseño de esta investigación corresponde a un estudio experimental in vitro. El protocolo de esta investigación obtuvo la aprobación del Comité de ética científico (CEC) de la Facultad de Odontología de la Universidad de los Andes. La unidad muestral fueron 30 dientes provenientes de individuos sanos de 18 a 60 años de edad que asistieron al Centro de Salud de San Bernardo (CESA) de la Universidad de los Andes y firmaron un consentimiento informado. Los criterios de inclusión correspondieron a: dientes uniradiculares, y sin anomalías anatómicas. Fueron excluidos dientes con fisuras, con rasgos de fracturas y con tratamiento endodontico previo. Los dientes fueron extraídos por razones quirúrgicas y/o de indicación de ortodoncia, mediante procedimientos rutinarios de exodoncia. Inmediatamente post extracción, las muestras dentales se mantuvieron en formalina al 10% para su posterior traslado al Centro de Investigación en Biología y Regeneración Oral (CIBRO) de la Universidad de los Andes, para su procesamiento.
Modelo de dientes in vitro
Los dos grupos experimentales fueron 15 dientes con coágulo de PRF y 15 con membrana de PRF. Se seccionaron los 30 dientes con un disco de diamante (Galaxy Disco de Diamante + Mandril de Ortho Technology) hasta el nivel amelo-cementario, para facilitar el acceso a los canales radiculares y la instrumentación apropiada a cada diente, estandarizado hasta una longitud de 15mm. Posteriormente, se realizó la preparación de los canales con instrumentación manual y mecanizada, de acuerdo a la siguiente secuencia: 1) La cavidad de acceso se realizó con fresa Endo-Z (AV 152X1 Dentsply-Maillefer, Suiza) para permitir un acceso preciso a los canales radiculares y una instrumentación adecuada. 2) El canal se permeabilizó con una lima K #10 (Zipperer 25mm, VDW, Munich, Alemania) y se estimó la longitud de trabajo antes señalada de 15mm. 3) Se realizó preparación química utilizando como irrigante 20 ml de hipoclorito de sodio (NaOCl) al 5,25% y se realizó preflaring cervical con fresas Gates-Glidden número 1 (32mm CA 1X1 VDW, Munich, Alemania). 4) Una vez finalizada la conformación del 1/3 coronario del canal radicular se confirmó la permeabilidad del tercio apical del canal utilizando una lima K#10 (Zipperer 25mm, VDW, Munich, Alemania). 5) Los dientes se conformaron con el sistema de limas Mtwo (VDW, Munich, Germany) hasta lima 40/04, utilizando el motor Endo Rec/Rot Silver Vdw (VDW, Munich, Alemania), siguiendo las indicaciones del fabricante para su uso. Para corroborar la estandarización del diámetro apical a 1,5 mm se midió utilizando una regla endodóntica (Microdont, Brasil). Para asegurar este diámetro se ensanchó con limas manuales hasta lograr 1.5 mm en sentido antero-posterior y mesio-distal. 6) Finalmente, se realizó un limado circunferencial con lima H # 40 (Zipperer 25mm, VDW, Munich, Alemania) para regularizar la superficie y dejarla lo más suave posible.
Desinfección de los dientes
Los dientes se desinfectaron con 2 mL de NaOCl al 1,5% y se agitaron en un vórtex durante 1 minuto, luego se centrifugaron a 1.700 rpm durante 2 minutos. Posteriormente, las muestras se sumergieron en otro tubo estéril que contenía una combinación de 1 mL de NaOCl al 1,5% y 1 mL de PBS (Buffer fosfato salino) 1x, después de lo cual se sometieron a vórtex y se centrifugaron nuevamente a 1700 rpm durante 2 minutos. Finalmente, los dientes se colocaron en un nuevo tubo estéril con 2 mL de PBS 1X y se agitaron en vórtex y se centrifugaron a 1700 rpm durante 2 minutos.
Preparación de fibrina rica en plaquetas (PRF)
El andamiaje del PRF se preparó partir de una muestra de sangre de un donante sano previa firma de un consentimiento informado. Las muestras de sangre fueron de 10 mL y se obtuvieron en un tubo de vidrio sin anticoagulante (Vacutainer ™Becton, Dickinson, USA). Inmediatamente se centrifugaron a 3000 rpm durante 10 minutos en una centrífuga Hettich EBA 200, según Dohan et al 2010. Después de la centrifugación, se retiró el coágulo PRF del tubo con una pinza estéril y se cortó con tijeras estériles desde la base de la capa inferior de glóbulos rojos. El coágulo se guardó en un tubo Falcon para posterior utilización. Para generar la membrana, otro coágulo obtenido se compactó en una caja de PRF (MedFlair instruments Co. Sialkot, Pakistan).
Implementación de los dientes
Los canales radiculares se trataron con 3 mL de EDTA al 17% hasta inundar el canal con una jeringa de tuberculina. El canal radicular fue secado con conos de papel estériles #40. Luego, cada membrana y coágulo PRF se cortó con un bisturí estéril en pequeños pedazos de aproximadamente 3 x 3 mm para facilitar la introducción al canal radicular. El coágulo de PRF como membrana se introdujo en el canal radicular previamente instrumentado, ubicándolo debajo de la unión amelo-cementaria, utilizando un compactador Machtou No 1-2, 3-4 (Dentsply-Maillefer, Suiza), que permitió ejercer una presión adecuada en el canal radicular. Cada diente se sumergió en medio de cultivo suplementado con α-MEM (Minimal Eagle Medium, Invitrogen, Carlsbad, CA) para la hidratación y se llevó a estufa a 37 °C durante 24 horas. Después de 24 horas, un operador previamente calibrado realizó un corte longitudinal de dientes con un disco de diamante. El diente se dividió en dos utilizando un elevador estéril con movimiento en forma de palanca. Los tercios de los dientes se dividieron en coronal, medio y apical (Figura 1). Para poder distinguir los andamiajes al interior del canal, se inyectó 0,3 mL de Azul tripán (Sigma) durante un minuto a los coágulos y membranas.
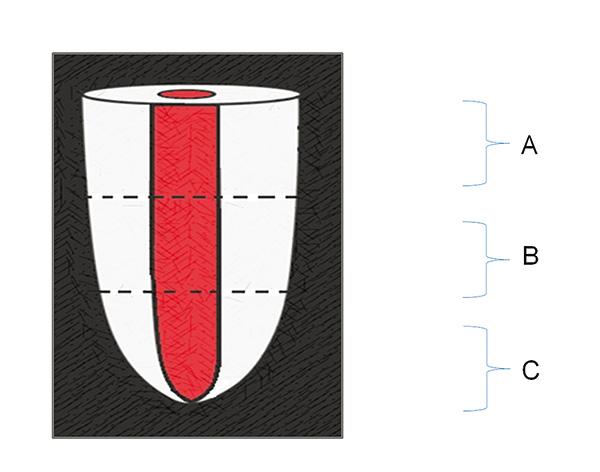
Figura 1. Esquema que muestra las divisiones seccionales
del diente correspondientes a los tercios dentales.
(A) Cervical (B) Medio (C) Apical. Lente macro,
zoom óptico 4x sin flash.
Evaluación de la distribución espacial
Se evaluaron dos cortes seccionales. Se eligió la sección que contenía el coágulo y membrana de PRF unido o adherido al canal en ambas mitades del diente (Figura 2). Se observaron los cortes con el microscopio óptico Zeiss Axioskop 50 y se capturaron imágenes usando una cámara Canon Powershot A640 para evaluar la presencia y distribución del coágulo y la membrana de PRF en los canales radiculares. Los parámetros de la cámara se estandarizaron en el modo AV con un valor de apertura de f8.0, zoom.
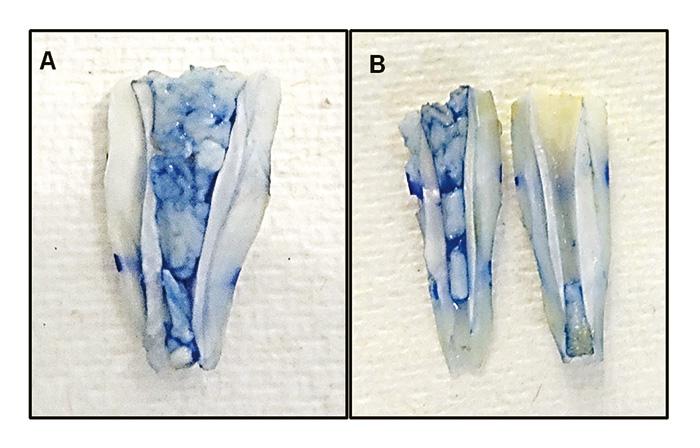
Figura 2. Cortes longitudinales teñidos con azul tripán.
(A) Corte de diente que muestra el PRF adherido
al canal radicular.
(B) Dos segmentos longitudinales de un diente con
PRF en el canal radicular. Magnificación 2,5X.
Distribución del coágulo y la membrana de PRF
Para comparar la distribución del coágulo y la membrana de fibrina rica en plaquetas en el canal radicular se observó la distribución de los andamiajes en los tres tercios A, B y C (Figura 1), tanto para el coágulo como para la membrana de PRF, cada uno por separado en el modelo in vitro. Se realizó un análisis de las fotografías tomadas con lente macro 2.5X para identificar la distribución del coágulo y membrana de PRF. Además se identificó la presencia de espacios libres en los tercios de la raíz; es decir, aquellos sitios del canal radicular no ocupados por la membrana o coágulo. Se asignó en forma arbitraria un valor de 1 cuando el andamiaje estaba presente en el tercio correspondiente, y un valor de cero cuando no estaba presente.
Se consideraron los resultados obtenidos por los tercios de los cortes longitudinales en el canal radicular.
Un segundo análisis fue la falta de continuidad entre las paredes del canal y el coágulo o membrana, es decir, se observó ocupación parcial o interrumpida del canal radicular. Se asignó un valor a cada tercio según las siguientes categorías:
1 = presencia de espacios libres.
0 = no presencia de espacios libres.
En ambos casos se realizó una sumatoria de todos los tercios tanto para la ausencia como con la presencia de espacios en el conducto radicular, obteniendo el porcentaje equivalente a la muestra total. Finalmente se procedió a realizar un análisis estadístico de los porcentajes de distribución de los andamiajes en los tercios del conducto radicular mediante el test Mann–Whitney con un intervalo de confianza del 95% mediante el programa STATA Versión 13.
Resultados
Utilizando las 30 muestras de dientes, se analizaron 90 imágenes (Figuras 3 y 4).
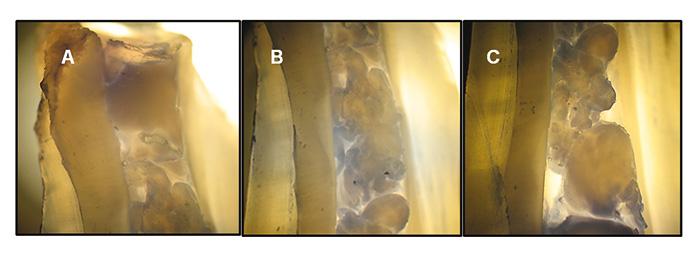
Figura 3. Imágenes microscópicas del coágulo de PRF en el canal radicular.
(A) Tercio apical (B) Tercio medio(C) Tercio cervical.
El coagulo de PRF se distribuye en todos los tercios del canal radicular del diente.
Magnificación 2,5x.

Figura 4. Imágenes microscópicas de la membrana de PRF en el canal radicular.
(A) Tercio apical (B) Tercio medio(C) Tercio cervical.
La membrana de PRF se distribuye en todos los tercios del canal radicular del diente.
Magnificación 2,5x.
Los dientes analizados correspondían al 100% con una distribución adecuada del coágulo y la membrana de PRF en los tres tercios del canal radicular (apical, medio y cervical). Por lo tanto, podemos concluir que no hay diferencias en la distribución espacial del coágulo y de la membrana de PRF en el canal radicular (Tabla 1).
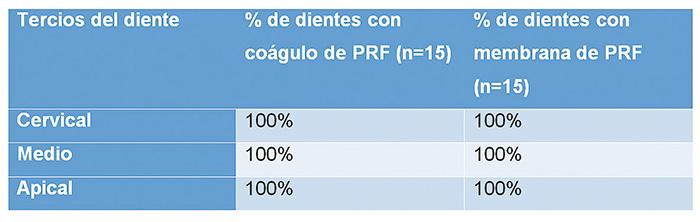
Tabla1. Análisis comparativo que muestra el % de muestras
analizadas con coágulo y membrana de PRF.
Se realizó un análisis estadístico de las muestras para determinar la presencia de espacios vacíos entre el coágulo o la membrana PRF con los bordes del canal radicular en las zonas apical, medio y cervical (Tabla 2). Comparando la presencia de estos espacios en ambos grupos experimentales, se percibe una tendencia de un menor porcentaje de espacios libres o vacíos en el conducto radicular en el tercio cervical, medio y apical del coágulo de PRF.
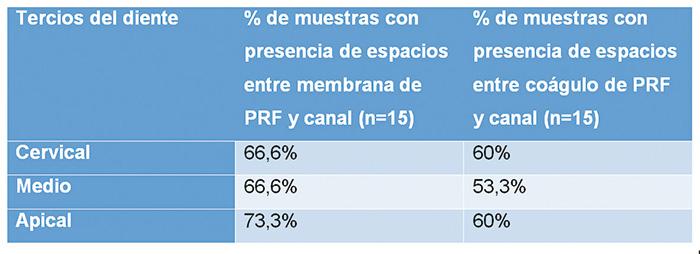
Tabla 2. Análisis comparativo que muestra el porcentaje de muestras que
evidencian la presencia de espacios vacíos entre el andamio y
el canal radicular,considerando los tercios apical, medio y cervical.
Discusión
A la fecha no existen estudios similares a éste. Se presentan varias referencias de la literatura que estudian los factores de crecimiento, estructura y propiedades de la membrana y el coágulo de PRF. Dohan y colaboradores en 2010 evaluaron en el tiempo los factores de crecimiento liberados por las plaquetas del PRF, diferenciando las fracciones obtenidas a distinto tiempo de obtención de las muestras (9). La comparación de estos datos muestra que el exudado de coágulo inicial puede ser rico en factores de crecimiento y, por lo tanto, la eliminación de este exudado podría disminuir las cantidades de factor de crecimiento dentro de la membrana (6)(17). Nuestra propuesta es irrigar con este mismo exudado la membrana, para no perder estos factores de crecimiento.
Bajo las condiciones experimentales en las que se realizó este estudio, se encontró que la manipulación de la membrana PRF es más difícil de introducir al interior del canal, ya que pierde su exudado, lo que puede causar su adhesión a las paredes interiores del conducto del diente. Esto no ocurre con el coágulo de PRF, que es más fácil de manejar para la colocación dentro del diente. Se sugiere un estudio que evalúe la variable de tiempo de trabajo utilizada, tanto en la preparación como en el manejo del coágulo y la membrana de PRF.
Otro aspecto importante a considerar es el corte seccional longitudinal del diente, que en algunos casos rompió la fibrina y esta se despegó; por lo tanto, es un desafío buscar otra manera de cortar los dientes, para permitir que la membrana y el coágulo de PRF permanezcan adheridos al canal radicular.
La búsqueda de matrices de transporte celular o de andamiaje en ingeniería de tejidos es un desafío que persiste. La fibrina rica en plaquetas es una de las herramientas más estudiadas en la actualidad, ya que imita una matriz autóloga, es fácilmente disponible y de bajo costo (7,11,18).
Este estudio no mostró diferencias en la distribución entre el coágulo y la membrana en el canal radicular del diente. El análisis microscópico de la distribución de PRF mostró que todas las muestras en este andamio tienen una distribución satisfactoria en los tres tercios del canal radicular, de acuerdo con la metodología utilizada en esta investigación.
Comparando la presencia de espacios en ambos grupos experimentales, es posible observar que en el tercio cervical, medio y apical el coágulo de PRF tiene un menor porcentaje de espacios libres en comparación a la membrana (Tabla 2).
A pesar de las limitaciones mencionadas anteriormente, los resultados obtenidos en este estudio nos permiten recomendar el uso de coágulos o membranas de PRF. El uso de PRF podría ser una matriz adecuada para procedimientos endodónticos regenerativos.
En pacientes con dientes permanentes y ápice cerrado, se recomienda el uso de coágulos de PRF, ya que un resultado deseable fue que el andamiaje alcanza a ocupar el tercio apical y puede servir como andamiaje para células madre de la papila. De acuerdo con esto, este estudio mostró un menor porcentaje de espacios del coágulo en el canal radicular en comparación con la membrana PRF (60% frente a 73.3%). En un diente inmaduro diagnosticado con periodontitis apical asintomática, se sugiere el uso de la membrana de PRF, ya que ésta distribuye adecuadamente en todos los tercios de los dientes.
Conclusión
En esta investigación podemos concluir que no hubo diferencias en la distribución espacial entre el coágulo y la membrana de PRF al interior del canal radicular. El uso de los andamiajes de PRF podría ser una alternativa apropiada para ser considerada en los procedimientos de endodoncia regenerativa.
AGRADECIMIENTOS
Los autores agradecen al Centro de Salud de San Bernardo (CESA) de la Facultad de Odontología de la Universidad de los Andes.
Referencias Bibliográficas
1. Diogenes A, Henry MA, Teixeira FB, Hargreaves KM. An update on clinical regenerative endodontics. Endod Top. 2013;28(1):2–23.
2. Pandit N, Malik R, Philips D. Tissue engineering: A new vista in periodontal regeneration. J Indian Soc Periodontol [Internet]. 2011 [cited 2013 Oct 16];15(4):328. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3283928/
3. Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood [Internet]. 2005 [cited 2013 Sep 30];105(4):1815–1822. Available from: http://bloodjournal.hematologylibrary.org/content/105/4/1815.short
4. Boccaccio A, Ballini A, Pappalettere C, Tullo D, Cantore S, Desiate A. Finite element method (FEM), mechanobiology and biomimetic scaffolds in bone tissue engineering. Int J Biol Sci [Internet]. 2011 [cited 2013 Apr 13];7(1):112. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3030147/
5. Howard D, Buttery LD, Shakesheff KM, Roberts SJ. Tissue engineering: strategies, stem cells and scaffolds. J Anat [Internet]. 2008 Jul [cited 2013 Apr 13];213(1):66–72. Available from: http://doi.wiley.com/10.1111/j.1469-7580.2008.00878.x
6. Choukroun J, Diss A, Simonpieri A, Girard M-O, Schoeffler C, Dohan SL, et al. Platelet-rich fibrin (PRF): A second-generation platelet concentrate. Part IV: Clinical effects on tissue healing. Oral Surg Oral Med Oral Pathol Oral Radiol Endodontology [Internet]. 2006 Mar [cited 2013 Apr 13];101(3):e56–60. Available from: http://linkinghub.elsevier.com/retrieve/pii/S1079210405005895
7. Dohan Ehrenfest DM, Del Corso M, Diss A, Mouhyi J, Charrier J-B. Three-Dimensional Architecture and Cell Composition of a Choukroun’s Platelet-Rich Fibrin Clot and Membrane. J Periodontol [Internet]. 2010 Apr [cited 2013 Apr 13];81(4):546–55. Available from: http://www.joponline.org/doi/abs/10.1902/jop.2009.090531
8. Shivashankar VY, Johns DA, Vidyanath S, Kumar MR. Platelet Rich Fibrin in the revitalization of tooth with necrotic pulp and open apex. J Conserv Dent JCD [Internet]. 2012 [cited 2013 Oct 14];15(4):395. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3482758/
9. Dohan Ehrenfest DM, Del Corso M, Diss A, Mouhyi J, Charrier J-B. Three-Dimensional Architecture and Cell Composition of a Choukroun’s Platelet-Rich Fibrin Clot and Membrane. J Periodontol [Internet]. 2010 Apr [cited 2013 Jun 24];81(4):546–55. Available from: http://www.joponline.org/doi/abs/10.1902/jop.2009.090531
10. Dohan Ehrenfest DM, Pinto NR, Pereda A, Jiménez P, Corso MD, Kang B-S, et al. The impact of the centrifuge characteristics and centrifugation protocols on the cells, growth factors, and fibrin architecture of a leukocyte-and platelet-rich fibrin (L-PRF) clot and membrane. Platelets. 2017;1–14.
11. Meschi N, Castro AB, Vandamme K, Quirynen M, Lambrechts P. The impact of autologous platelet concentrates on endodontic healing: a systematic review. Platelets. 2016 Oct 2;27(7):613–33.
12. Shivashankar VY. Comparison of the Effect of PRP, PRF and Induced Bleeding in the Revascularization of Teeth with Necrotic Pulp and Open Apex: A Triple Blind Randomized Clinical Trial. J Clin Diagn Res [Internet]. 2017 [cited 2018 Oct 10]; Available from: http://jcdr.net/article_fulltext.asp?issn=0973-709x&year=2017&volume=11&issue=6&page=ZC34&issn=0973-709x&id=10056
13. Dohan DM, Choukroun J, Diss A, Dohan SL, Dohan AJ, Mouhyi J, et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part I: technological concepts and evolution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;101(3):e37–44.
14. Brizuela C, Galleguillos S, Carrión F, Cabrera C, Luz P, Inostroza C. Aislación y Caracterización de Células Madre Mesenquimales Provenientes de Pulpa y Folículo Dentario Humano. Int J Morphol. 2013;31(2):739–46.
15. Horst OV, Chavez MG, Jheon AH, Desai T, Klein OD. Stem Cell and Biomaterials Research in Dental Tissue Engineering and Regeneration. Dent Clin North Am [Internet]. 2012 [cited 2013 Oct 2];56(3):495–520. Available from: http://linkinghub.elsevier.com/retrieve/pii/S0011853212000419
16. Kuo R-Z, Lee G-G. Knowledge management system adoption: exploring the effects of empowering leadership, task-technology fit and compatibility. Behav Inf Technol [Internet]. 2011 Enero [cited 2013 Jun 20];30(1):113–29. Available from: http://dx.doi.org/10.1080/0144929X.2010.516018
17. Anitua E, Prado R, Nurden A, Nurden P. Characterization of Plasma Rich in Growth Factors (PRGF): components and formulations. In: Platelet Rich Plasma in Orthopaedics and Sports Medicine. Springer; 2018. p. 29–45.
18. Anitua E, Alkhraisat MH, Orive G. Perspectives and challenges in regenerative medicine using plasma rich in growth factors. J Controlled Release [Internet]. 2012 [cited 2013 Sep 20];157(1):29–38. Available from: http://linkinghub.elsevier.com/retrieve/pii/S0168365911004810
Autor de correspondencia:
Claudia Brizuela C
e-mail: clau@cibrizuela.com
Recibido: 9/7/2019
Aceptado: 26/7/2019
Los autores declaran que no existe conflicto de interés.







