Revista Canal Abierto 41 | Artículo Científico
Biocerámicos en odontología, una revisión de literatura
Aceptado: 02-03-2020
Páginas 14-21
Francisca Espinoza 1 Aldo Lizana 1 Paulina Muñoz 1 




1 Postítulo Especialización Endodoncia, Facultad Odontología, Universidad San Sebastián, Santiago de Chile
Resumen
Los materiales biocerámicos en endodoncia permiten la resolución de casos en que los materiales utilizados previamente no tenían buen pro- nóstico. Al ser biocompatibles con los tejidos humanos, inducen su repa- ración, generando aposición de hidroxiapaita, mediante el proceso de hi- dratación del silicato de calcio. Las propiedades que poseen les entregan excelentes prestaciones clínicas y son ideales para aplicar dentro y fuera del canal radicular. Las presentaciones comerciales pueden ser premez- cladas o en dos fases que se mezclan, variando su composición, consis- tencia, tiempos de trabajo y de fraguado.
En la literatura disponible se ha comprobado que los materiales bioce- rámicos tienen un potencial osteoconductivo y osteoinductivo, estimu- lan la diferenciación celular y mediante el proceso de biomineralización forman hidroxiapaita al tomar contacto con fluidos fisiológicos que presentan fosfato.
Esta revisión incluye algunas aplicaciones de estos materiales. En la ob- turación retrógrada permiten una mejor manipulación y menor tiempo de trabajo que MTA. En perforaciones radiculares en la zona de furca o paredes del canal radicular otorgan una barrera con propiedades mecá- nicas aceptables, incluso, en condiciones de humedad. Pueden rellenar reabsorciones radiculares externas o internas con o sin perforación del canal. En casos de formación radicular incompleta se puede establecer una barrera apical. En dientes vitales, el recubrimiento pulpar con bio- cerámicos alcanza mayor tasa de éxito que con Hidróxido de Calcio. En dientes permanentes inmaduros con necrosis pulpar mediante la revas- cularización pueden inducir la regeneración del complejo dentino-pulpar continuando el desarrollo radicular. Al usarlos como cemento sellador tienen la capacidad de expandirse en presencia de humedad.
Palabras Claves: Biocerámicos, biomineralización, obturación radicular, perforación radicular, reabsorción radicular, revascularización.
Abstract
The bioceramic materials in endodontics allow the resolution of ca- ses in which the previously used materials did not have a good prog- nosis. Being biocompatible with human tissues, they induce their repair, generating apposition of hydroxyapaite, through the process of hydration of calcium silicate. The properties they possess provide excellent clinical benefits and are ideal for applying inside and outsi- de the root canal. Commercial presentations can be premixed or in two phases that are mixed, varying their composition, consistency, working and setting times.
In the available literature it has been proven that bioceramic ma- terials have an osteoconductive and osteoinductive potential, sti- mulate cell differentiation and, through the biomineralization pro- cess, form hydroxyapaite by contacting physiological fluids that have phosphate.
This review includes some applications of these materials. In retro- grade filling they allow better handling and less working time than MTA. Root perforations in the furca area or walls of the root canal provide a barrier with acceptable mechanical properties, even in moist conditions. They can fill external or internal root resorption with or without canal perforation. In cases of incomplete root for- mation an apical barrier can be established. In vital teeth, the pulp capping with bioceramics achieves a higher success rate than with Calcium Hydroxide. In immature permanent teeth with pulp necro- sis by revascularization, they can induce the regeneration of the dentin-pulp complex by continuing root development. When used as root canal seal they have the ability to expand in the presence of moisture.
Key words: Bioceramics, biomineralization, root canal filling, root perforation, root resorption, revascularization.
Introdución
Los biocerámicos son materiales biocompatibles, no tóxicos, estables en entornos biológicos, no se contraen y más bien se expanden ligeramente tras la finalización del proceso de fraguado. Son capaces de formar hidro- xiapatita en presencia de agua, siendo un material no sensible en presen- cia de humedad (1).
En endodoncia, los materiales biocerámicos fueron introducidos en la dé- cada del 90 con el desarrollo y descripción del Agregado de Trióxido Mine- ral (MTA), un derivado del cemento de Portland (2).
Diversas líneas de investigación buscan demostrar la presencia de biomi- neralización en la interface biocerámico - dentina, evaluar la capacidad de inducir la proliferación de fibroblastos periodontales, establecer la diferen- ciación de células de la pulpa dental y determinar la bioactividad de los biocerámicos (3,4).
En razón de lo anteriormente expuesto, se realizó una recopilación de la información disponible respecto a materiales biocerámicos, con el objeti- vo de conocer los aspectos que se han estudiado, sus propiedades y usos.
Definición de Biocerámicos Los biocerámicos (BC) son materiales cerámicos, inorgánicos, no metálicos y biocompatibles diseñados para uso médico y odontológico, están consti- tuidos por alúmina, zirconio, vidrio bioactivo, cerámica de vidrio, silicato de calcio, hidroxiapatita y fosfatos de calcio reabsorbibles (5). De acuerdo a la interacción que tienen con los tejidos se pueden clasificar como:
- Bioinertes: No interactúan con los sistemas biológicos (alúmina y zirco- nio producen una respuesta insignificante en el tejido circundante) (5).
- Bioactivos: Son aquellos que no se degradan pero interactúan con el teji-
do circundante (vidrio, fosfato de calcio, hidroxiapatita) (5).
- Biodegradables: Son solubles o reabsorbibles (5).
Fraguado de los Biocerámicos
Los BC son materiales hidrofílicos que utilizan el agua presente en los tú- bulos dentinarios para su hidratación, contienen entre otros materiales silicato de calcio que luego de pasar por este proceso de hidratación forma un gel de silicato de calcio o hidrogel e hidróxido de calcio (6).
Posterior a esto, los iones de fosfato presentes reaccionan con el hidróxi- do de calcio produciendo la precipitación de hidroxiapatita en la interface dentina/material BC y agua, creando no solo una unión física con el tejido dentario, sino también química. El agua generada participa nuevamente en el proceso de hidratación (6).
Propiedades de los Materiales Biocerámicos
Propiedades Físico - Químicas
Fuerza de unión: Valores para selladores BC en canales húmedos de 1.8 MPa y en canales secos de 3 MPa (7). Los materiales de reparación mues- tran valores mayores MTA 6.1, TotalFill RRM 17,7 MPa y Biodentine 8,7 MPa (8,9).
Radiopacidad: Cumplen la norma ISO 6876: 2012. Radiopacidad mayor que un espesor de 3 mm. de aluminio (1).
Solubilidad: Según norma ANSI / ADA < 3% (0,9-2.9 %) (1).
Tiempo de Fraguado: Promedio de fraguado de 40-120 minutos (fraguado inicial 40-50 minutos y fraguado final 120-170 minutos, no incluyendo a The- raCal, que es fotopolimerizado en 0,3 minutos y Biodentine que fragua en 9 minutos (10). La reacción de fraguado variará con la humedad disponible (5). Estabilidad Dimensional: No presentan contracción, experimentan una ligera expansión de fraguado. Cumplen con la norma ISO 6876/2001, dis- minuyendo la filtración posterior del material (11).
Fluidez: Según norma ISO 6876:2001, asociado al tamaño de partícu- las de 2 µ (12).
pH alcalino alto: pH superior a 12,4 las primeras 24 horas, posteriormente se mantiene alcalino y desciende progresivamente hasta el día 28 (10).
Resistencia a la fractura: Resistencia a la compresión y flexión superior a otros materiales. Biorrot 621,38 ± 145,09 N, TotalFill 516 ± 90,63 N(13).
Propiedades Biológicas
Biocompatibilidad y Citoxicidad: Los BC son materiales biocompatibles debido a que logran una adecuada y ventajosa respuesta del huésped en aplicaciones clínicas específicas (13).
La biocompatibilidad de los BC se atribuye a la presencia de fosfato de calcio, que también es el principal componente inorgánico de los tejidos duros. Los BC son inocuos para los tejidos y permiten la proliferación de fibroblastos y osteoblastos en su superficie (14).
Bioactividad y Biomineralización: La bioactividad es la capacidad de un biomaterial para inducir una respuesta biológica específica. Al hidratarse forman una capa de hidroxiapatita, proceso denominado biomineralización (3).Capacidad Antibacteriana: Adquieren propie- dades antibacterianas tras la reacción de precipitación durante el fra- guado, que conduce al secuestro de bacterias. Generan superficies con nanocristales de 1-3 nm, que evitan la adhesión bacteriana (15).
La reacción de hidratación produce hidróxido de calcio que eleva el pH, lo que se prolonga por 30 días. La difusión continua de hidróxido de calcio en los túbulos dentinarios explicaría la continua eliminación de bacterias (3).
Clasificación de los Biocerámicos
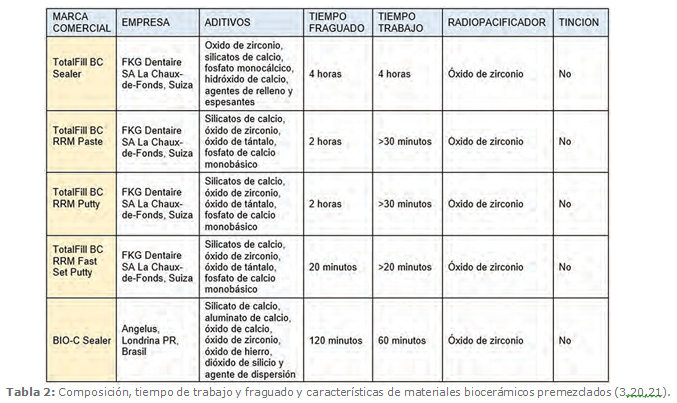
De acuerdo a su presentación, los BC están disponibles en dos fases (Tabla
1) que deben ser mezcladas (polvo - líquido) o en una fase (Tabla 2), pre- mezclada.
Biocerámicos Bifásicos

5.2 Biocerámicos Premezclados
Análisis de la Evidencia Científica
La hidratación de BC produce hidroxiapatita; cuando esta toma con- tacto con el tejido óseo tiene un efecto osteoconductivo, guiando la formación ósea. Además, BC tienen una capacidad osteoinductiva in- trínseca, debido a que absorben sustancias osteoinductivas si hay un proceso de cicatrización óseo cercano (15).
Los materiales en base a silicato de calcio como MTA tienen la capaci- dad de inducir la proliferación de fibroblastos periodontales y permitir la diferenciación de células de la pulpa dental, osteoblastos y similares a osteoblastos, células madre mesenquimatosas y cementoblastos. BC tienen la capacidad de promover la diferenciación de células madre me- senquimales, lo que induce la reparación periapical (4).
Al utilizar BC al interior del canal radicular puede mejorar el sellado por la deposición de fosfatos de calcio en la interfase y dentro de los túbulos dentinarios (3).
Estudios in vitro han demostrado que la precipitación de MTA en pre- sencia de solución tamponada con fosfato (PBS) promueve el proceso de biomineralización, que conduce a la formación de estructuras simi- lares a tags en la interfase cemento-dentina, sin embargo, hay pocos datos de la ocurrencia del proceso in vivo. Reyes Carmona evaluó la bio- mineralización en ratones mediante la implantación en el tejido subcu- táneo de tubos de dentina llenos de MTA, observando la deposición de apatita sobre las fibrillas de colágeno de la superficie de los tubos de dentina, siendo los primeros en mostrar que el proceso de biominerali- zación ocurre junto con la respuesta inflamatoria aguda (22,23).
Dreger en 2012, al observar la deposición de minerales en la interfase dentina-cemento (capa interfacial) y en el interior de los túbulos, plan- teó que los iones de calcio liberados del BC reaccionan con los iones fosfato disponibles en el fluido del tejido, precipitando en apatita car- bonatada. La capacidad de estos materiales de precipitar apatita en su superficie cuando están en contacto con un tejido calcificado puede formar una adhesión química a éste (24).
La bioactividad de los materiales en base a silicato de calcio como MTA se atribuye a la capacidad de liberar iones de calcio (Ca2 +) y producir precipitados cristalinos de tipo apatita cuando están en contacto con fluidos fisiológicos que contienen fosfato. El aumento resultante en pH y concentración de (Ca2 +) aumenta la saturación del fluido que contie- ne fosfato con respecto a la apatita y, por lo tanto, promueve la precipi- tación (25). Los iones (Ca2 +), cuando entran en contacto con el tejido conectivo forman dióxido de carbono, el que reacciona con hidróxido de calcio formando cristales de calcita (carbonato de calcio), que sirven como núcleo de calcificación. La alcalinidad del medio estimula la for- mación de fibronectina, que con los cristales de calcita inducen la forma- ción de colágeno tipo I y junto con el calcio induce mineralización (26).
Usos Clínicos
Obturación Retrógrada
BC aplicados en cavidades de cirugía apical han demostrado un sella- do eficiente y duradero, siendo más biocompatibles que los materia- les comúnmente utilizados. La ventaja que tienen es la formación de cemento y hueso en el área periapical, lo que ha sido histológicamen- te demostrada in vivo en animales (10).
MTA es un excelente material, pero su consistencia dificulta la inser- ción en la cavidad apical. Además, MTA recién mezclado puede des- alojarse si se expone a líquidos, su tiempo de fraguado prolongado afecta la capacidad de sellado (27). RRM Putty, RRM Fast Set Putty y RRM Paste en la práctica clínica tienen una colocación más fácil al ser premezclados. Biodentine es otro material que puede ser utilizado en este procedimiento por su consistencia, manipulación y tiempo de fraguado rápido (8).
Reparación de Perforaciones
La perforación se caracteriza por una comunicación entre el siste- ma de canal radicular y la superficie externa del diente. Puede ser causado por un proceso patológico o iatrogenia durante un proce- dimiento (28).
El uso de MTA y otros materiales biocerámicos aumentan la previsi- bilidad a largo plazo de los procedimientos de reparación de perfora- ción. La elección del material de reparación está determinada por el área y accesibilidad al sitio de perforación, la capacidad de controlar los fluidos y factores estéticos (29).
Perforaciones de Furcas
El área y tamaño de la perforación son los principales determinantes al seleccionar el material de reparación (14).
En perforaciones supracrestales que no tienen compromiso periodon- tal, se pueden usar materiales restauradores convencionales como el vidrio ionómero o resina compuesta (30). Sin embargo, si la perfora- ción es pequeña y apical a la unión cemento-esmalte, los BC son una mejor opción porque toleran la humedad y aseguran un mejor sello a largo plazo con la dentina (14).
En perforaciones extensas, en particular en casos con grandes lesio- nes de furca, debe considerarse una matriz de colágeno reabsorbible previo a la colocación de BC. Sin embargo, la ligera extrusión del ma- terial no es relevante (14).
Los BC se pueden aplicar con un porta MTA, en pequeñas porciones y condensar con un instrumento de diámetro invertido (14). La perfora- ción debe ser sellada después de localizar los canales, colocando ins- trumentos endodónticos dentro éstos para evitar su obstrucción (2).
Perforaciones Laterales
Si la perforación ocurre en el tercio coronal, se sella con BC, protegien- do el canal radicular con un cono de guttapercha con taper. Para ello se utiliza una punta dispensadora o porta MTA y luego se compacta con conos de papel o atacadores que ajusten al diámetro del canal (2).
En las perforaciones del tercio medio radicular, se debe intentar limpiar y formar el canal apical a la perforación de la raíz, intentando obturar el canal apical a la perforación con guttapercha y sellador (evitar su ingre- so a la perforación). Posterior al control radiográfico, el resto del canal se rellena con BC (2).
El tercio apical puede ser obturado usando compactación vertical ca- liente. Cuando no es posible acceder al canal apical con esta técnica, se puede obturar el tercio apical con RRM Paste (utilizando un léntulo para acceder a la zona apical) y luego RRM Putty, otra alternativa es utilizar Biodentine, MTA Flow en consistencia de masilla u otro material BC que pueda ser compactado (14).
En perforaciones apicales, se debe establecer una nueva longitud de tra- bajo, creando un tope apical con BC y obturar el canal hacia coronal (2).
En canales estrechos con perforación, se utiliza un cemento sellador BC acompañado de un cono de guttapercha. En canales medianos y gran- des, todo el canal apical, incluyendo la perforación, puede sellarse con un BC, tal como MTA, RRM Putty, RRM Putty Fast Set o Biodentine(14).
Reabsorción Radicular
La reabsorción de la raíz es la destrucción no bacteriana del cemento mineralizado o dentina debido a la interacción de células clásticas y dentales de tejidos duros y blandos, y se clasifican de acuerdo a su ubi- cación en la superficie radicular (30).
Reabsorción Radicular Interna
Si la reabsorción es interceptada antes de la perforación y el manejo es similar al tratamiento convencional, utilizando un relleno mediante técnicas termoplásticas para garantizar su adaptación y compactación (30). En los casos en que hay perforación radicular, es necesaria la uti- lización de BC en forma ortógrada, y puede ser necesario un abordaje quirúrgico posterior (30).
Reabsorción Radicular Externa
El tratamiento tiene por objetivo la eliminación del tejido reabsoben- te, sellar el defecto en la superficie radicular con un material estético biocompatible y prevenir la recurrencia de la reabsorción. El manejo dependerá de su accesibilidad y restaurabilidad determinada median- te la exploración en el CBCT. Si la reabsorción externa ha perforado las paredes del canal radicular, el tratamiento endodóntico puede ser necesario (31). En caso de perforación es necesario ocluir momentáneamente el canal radicular con un cono de gutapercha, previo al sellado del defecto para mantener la permeabilidad al condensar del material (31).
Relleno Ortógrado del Canal Radicular
El canal puede ser obturado parcial o completamente con un BC cuan- do posiblemente se requerirá una cirugía apical. La cantidad de relleno apical depende del plan de tratamiento; el espesor mínimo debe ser de 2-3 mm, y en los casos en que la apicectomía esté prevista, 5-7 mm (14).
Formación Radicular Incompleta
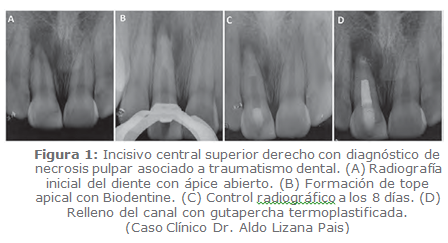
La utilización de MTA es una técnica que reemplaza al tratamiento con Ca(OH)2; Esta técnica tiene resultados exitosos y no requiere va- rias citas como en el caso de la utilización de Ca(OH)2 (32).
MTA es uno de los materiales preferidos para el manejo de dientes con ápices abiertos debido a su capacidad para actuar como barrera apical osteocondutiva. La liberación continua de iones de calcio, fosfato e hidroxilo permite que el MTA participe en el proceso de regeneración y remineralización de los tejidos duros, mejorando la capacidad de se- llado por la aposición de cristales de hidroxiapatita en la interfase (33).
La aplicación intracanal de hidróxido de calcio durante una semana puede mejorar la adaptación marginal del BC a las paredes de la den- tina, debido a la capacidad del hidróxido de calcio para eliminar los restos de tejido (2).
Recubrimiento Pulpar
El BC aplicado en recubrimiento pulpar ha demostrado mayor tasa de éxito que hidróxido de calcio, debido a su capacidad de sellado, menor solubilidad y mejores propiedades mecánicas (26).
Después de la limpieza mecánica del área de exposición y controlada la hemorragia, se desinfecta con NaClO al 5%. MTA u otro BC, se aplica con un espesor de 1.5 a 3.0 milímetros sobre el sitio de exposición y la dentina circundante, dejando 1 a 2 mm de dentina y esmalte disponibles circunferencialmente para la unión de la restauración definitiva (2,26).
Pulpotomía y Revascularización
En dientes con indicación de pulpotomía, se retira la pulpa cameral e irriga con solución salina. Luego de controlar la hemorragia, la pulpa se cubre con una capa de MTA u otro BC, aplicado sin presión con un porta amalgama, en un espesor de 1.5 a 3.0 mm. El BC se cubre con una delgada capa de vidrio ionómero o resina antes de restaurar. La humedad necesaria para el fraguado del BC derivará de la pulpa re- manente (2,26).
En la literatura de endodoncia, revascularización, revitalización y en- dodoncia regenerativa se usan como sinónimos que son intercambia- bles. La revascularización tiene como objetivo regenerar el complejo pulpa-dentina dañado de dientes permanentes inmaduros con pulpa necrótica(34).
En aquellos dientes en los que se indique revascularización, después de la instrumentación y la medicación con hidróxido de calcio, se es- timula el sangrado con un instrumento endodóntico calibre 10 o 15 que sobrepasa el foramen. Con una mota de algodón estéril, la sangre se comprime a nivel cervical, hasta obtener un coágulo a 3 mm del límite amelo-cementario. Se coloca un tapón de BC de 3 a 4 mm de espesor, para luego ser sellado con vidrio ionómero (2,26). Se debe realizar controles postoperatorios cada 3 a 6 meses durante al menos 1 a 2 años, y al finalizar este periodo el resultado exitoso se debe pre- sentar clínicamente con un diente asintomático y radiográficamente con resolución de lesiones apicales, engrosamiento de las paredes del canal y aumento de la longitud de la raíz (2).

Cemento Sellador
El sellador BC se diferencia de un sellador tradicional por ser hidrofílico y por lo tanto la humedad en el canal y los túbulos es una ventaja, a diferencia de la mayoría de los selladores donde la humedad es perjudicial para su rendimiento. Además, el se- llador se expande ligeramente y es insoluble en los fluidos tisu- lares (6).
Tradicionalmente en la técnica de compactación lateral se uti- liza un núcleo de guttapercha y conos accesorios, junto a un sellador que rellena los espacios entre estos conos y la pared dentinaria. El sellador (en base a resina epóxica, óxido de zinc eugenol, hidróxido de calcio.) se contrae durante el fraguado y, para minimizar esto, la cantidad de sellador debe ser del menor espesor posible(6).
La preparación con un instrumento de conicidad constante per- mite dar al canal una forma predecible y reproducible por el cono de gutapercha correspondiente, se genera una hidráulica superior respecto a preparaciones con conicidades variables. Esta técnica logra un estrecho vínculo entre la pared del canal radicular y el cono maestro y se denomina Condensación Hi- dráulica Sincronizada (35).
No obstante, la penetración del material sellador a los túbulos dentinarios puede dificultar el retratamiento endodóntico por el bloqueo de estos, afectando la recuperación de la pared den- tinaria (36).

Referencias Bibliográficas
- Abusrewil SM, McLean W, Scott JA. 2018. The use of Bioceramics as root- end filling materials in periradicular surgery: A literature review. Saudi Dent J. 30(4):273–282. doi:10.1016/j.sdentj.2018.07.004.
- AL-Haddad A, Che Ab Aziz ZA (2016). Bioceramic-Based Root Canal Sea- lers: A Review. Int. J. Biomater. 2016:1–10.
- Bramante CM, Kato MM, Assis GF de, Duarte MAH, Bernardineli N, Mo- raes IG de, et al. (2013). Biocompatibility and setting time of CPM-MTA and white Portland cement clinker with or without calcium sulfate. J. Appl. Oral Sci. 21:32–36.
- Brave D, Koch K, Nasseh AA (2012). A review of bioceramic technology in endodontics. Roots 4.
- Camilleri J, editor (2014). Mineral Trioxide Aggregate in Dentistry. Berlin, Heidelberg: Springer Berlin Heidelberg. Available at: http://link.springer. com/10.1007/978-3-642-55157-4 [Accessed September 4, 2017]
- Camilleri J (2015). Mineral trioxide aggregate: present and future develop- ments. Endod. Top. 32:31–46.
- Curtius Seutter von Loetzen , S; Hülsmann, M (2018). Root perforation re- pair concepts and materials: A review. ENDO (Lond Engl) 2018;12(2):87–100.
- Debelian G, Trope M (2016). The use of premixed bioceramic materials in endodontics. G. Ital. Endodonzia 30:70–80.
- Dreger LAS, Felippe WT, Reyes-Carmona JF, Felippe GS, Bortoluzzi EA, Fe- lippe MCS (2012). Mineral Trioxide Aggregate and Portland Cement Promote Biomineralization In Vivo. J. Endod. 38:324–329.
- Estrela C, Decurcio D de A, Rossi-Fedele G, Silva JA, Guedes OA, Borges ÁH. 2018. Root perforations: a review of diagnosis, prognosis and mate- rials. Braz Oral Res. 32(suppl 1). doi:10.1590/1807-3107bor-2018.vol32.0073. [accessed 2019 Aug 29]. http://www.scielo.br/scielo.php?script=sci_ arttext&pid=S1806-83242018000500608&lng=en&tlng=en.FKG Dentaire (2016). TotalFill® Premixed Bioceramic Materials. Switzerland. Available at: www.fkg.ch
- Gandolfi MG, Taddei P, Modena E, Siboni F, Prati C (2013). Biointeracti- vity-related versus chemi/physisorption-related apatite precursor-forming ability of current root end filling materials: Biointeractivity-Related Versus Chemi/Physisorption-Related Apatite. J. Biomed. Mater. Res. B Appl. Bioma- ter. 101:1107–1123.
- Guerrero F, Mendoza A, Ribas D, Aspiazu K. 2018. Apexification: A syste- matic review. J Conserv Dent. 21(5):462. doi:10.4103/JCD.JCD_96_18.
- Güven EP, Taşlı PN, Yalvac ME, Sofiev N, Kayahan MB, Sahin F (2013). In vitro comparison of induction capacity and biomineralization ability of mi- neral trioxide aggregate and a bioceramic root canal sealer. Int. Endod. J. 46:1173–1182.
- Haapasalo M, Parhar M, Huang X, Wei X, Lin J, Shen Y (2015). Clinical use of bioceramic materials. Endod. Top. 32:97–117.
- Han L, Kodama S, Okiji T (2015). Evaluation of calcium-releasing and apatite-forming abilities of fast-setting calcium silicate-based endodontic materials. Int. Endod. J. 48:124–130.
- Jitaru S, Hodisan I, Timis L, Lucian A, Bud M (2016). The use of biocera- mics in endodontics - Literature review. Clujul Med. 89:470.
- Kim H, Kim E, Lee S-J, Shin S-J (2015). Comparisons of the Retreatment Efficacy of Calcium Silicate and Epoxy Resin–based Sealers and Residual Sea- ler in Dentinal Tubules. J. Endod. 41:2025–2030.
- Kim SG, Malek M, Sigurdsson A, Lin LM, Kahler B. 2018. Regenerati- ve endodontics: a comprehensive review. Int Endod J. 51(12):1367–1388. doi:10.1111/iej.12954 Kohli MR, Yamaguchi M, Setzer FC, Karabucak B (2015). Spectrophotometric Analysis of Coronal Tooth Discoloration Induced by Various Bioceramic Ce- ments and Other Endodontic Materials. J. Endod. 41:1862–1866.
- Ma J, Shen Y, Stojicic S, Haapasalo M (2011). Biocompatibility of Two No- vel Root Repair Materials. J. Endod. 37:793–798.
- Malhotra S (2014). Bioceramic Technology in Endodontics. Br. J. Med. Med. Res. 4:2446–2454.
- Nagas E, Uyanik MO, Eymirli A, Cehreli ZC, Vallittu PK, Lassila LVJ, et al. (2012). Dentin Moisture Conditions Affect the Adhesion of Root Canal Sea- lers. J. Endod. 38:240–244.
- Patel S, Foschi F, Condon R, Pimentel T, Bhuva B. 2018. External cervical resorption: part 2 - management. Int Endod J. 51(11):1224–1238. doi:10.1111/ iej.12946. Patel S, Saberi N. 2018. The ins and outs of root resorption. Br Dent J. 224(9):691–699. doi:10.1038/sj.bdj.2018.352.
- Prati C, Gandolfi MG (2015). Calcium silicate bioactive cements: Biologi- cal perspectives and clinical applications. Dent. Mater. 31:351–370.
- Rajasekharan S, Martens LC, Cauwels RGEC, Verbeeck RMH (2014). Bio- dentineTM material characteristics and clinical applications: a review of the literature. Eur. Arch. Paediatr. Dent. 15:147–158.
- Reyes-Carmona JF, Felippe MS, Felippe WT (2009). Biomineralization Ability and Interaction of Mineral Trioxide Aggregate and White Portland Cement With Dentin in a Phosphate-containing Fluid. J. Endod. 35:731–736.
- Reyes-Carmona JF, Felippe MS, Felippe WT (2010). The Biomineralization Ability of Mineral Trioxide Aggregate and Portland Cement on Dentin Enhan- ces the Push-out Strength. J. Endod. 36:286–291.
- Saed SM, Ashley MP, Darcey J. 2016. Root perforations: aetiology, mana- gement strategies and outcomes. The hole truth. Br Dent J. 220(4):171–180. doi:10.1038/sj.bdj.2016.132.
- Shen Y, Peng B, Yang Y, Ma J, Haapasalo M (2015). What do different tests tell about the mechanical and biological properties of bioceramic materials? Endod. Top. 32:47–85.
- Shin S, Chen I, Karabucak B, Baek S, Kim S. 2017. MTA and Bioceramic Root End Filling Materials. In: Microsurgery in Endodontics. Hoboken, NJ, USA: John Wiley & Sons, Inc. p. 91–99. [accessed 2019 Aug 29]. http://doi. wiley.com/10.1002/9781119412502.ch11.
- Shokouhinejad N, Razmi H, Nekoofar M, Sajadi S, Dummer P, Khos- hkhounejad M (2013). Push-Out Bond Strength of Bioceramic Materials in a Synthetic Tissue Fluid. J. Dent. Tehran Iran 10:540–547.
- Silva Almeida LH, Moraes RR, Morgental RD, Pappen FG (2017). Are Pre- mixed Calcium Silicate–based Endodontic Sealers Comparable to Conventio- nal Materials? A Systematic Review of In Vitro Studies. J. Endod. 43:527–535.
- Torabinejad M (2014). Mineral trioxide aggregate: properties and clinical applications.
- Tran D, He J, Glickman GN, Woodmansey KF (2016). Comparative Analysis of Calcium Silicate–based Root Filling Materials Using an Open Apex Model. J. Endod. 42:654–658.
- Trope M, Bunes A, Debelian G (2015). Root filling materials and techni- ques: bioceramics a new hope? Endod. Top. 32:86–96.
- Vallés M, Roig M, Duran-Sindreu F, Martínez S, Mercadé M (2015). Color Stability of Teeth Restored with Biodentine: A 6-month In Vitro Study. J. En- dod. 41:1157–1160.
- Zhou H, Shen Y, Zheng W, Li L, Zheng Y, Haapasalo M (2013). Physical Properties of 5 Root Canal Sealers. J. Endod. 39:1281–1286.