Revista Canal Abierto 43 | Artículo Científico
Persistencia Bacteriana Post-tratamiento Endodóntico: Implicaciones Clínicas y Estrategias Terapéuticas
Aceptado: 04-03-2021
Páginas 14-24
Alejandro R. Pérez1 Gaya C. S. Vieira1 Sebastián Ortolani-Seltenerich2
1 Departamento de Investigación en Odontología, Facultad de Odontología, Universidad de Iguaçu (UNIG), Nova Iguaçu, Río de Jameiro, Brasil. 2 Departamento de Patología Dental y Terapéutica, Universidad Católica San Antonio de Murcia, Murcia, España.
Resumen
El éxito del tratamiento endodóntico en dientes con periodontitis apical depende del control efectivo de la infección intracanal y, en ese sentido. la preparación químicomecánica juega un papel fundamental en la eliminación o disminución de bacterias a niveles compatibles con la reparación de los tejidos. La instrumentación e irrigación tienen como objetivo la limpieza, desinfección y conformación del canal radicular. No obstante, las curvaturas y las complejas variaciones anatómicas internas pueden plantear un alto grado de dificultad para alcanzar estos objetivos. Si las bacterias resisten a los procedimientos intracanal, existe un mayor riesgo de fracaso del tratamiento endodóntico. Este artículo describe las razones por las que algunas áreas no son debidamente desinfectadas durante el tratamiento y analiza estrategias para mejorar el control de la infección durante los procedimientos endodónticos.
Palabras clave: Desinfección del canal radicular, Periodontitis apical, Pronóstico del tratamiento, Superficies no instrumentadas.
Abstract
The success of endodontic treatment in teeth with apical periodontitis depends on the effective control of the intracanal infection. In this sense, the chemomechanical preparation plays a pivotal role in eliminating or reducing bacteria to levels compatible with tissue repair. The main goals of chemomechanical procedures are cleaning, shaping, and disinfecting the root canal. However, curvatures and complex internal anatomy could pose a high degree of difficulty in achieving these goals. If bacteria persist to intracanal procedures, there is an increased risk of endodontic treatment failure. This article describes why some areas are not adequately disinfected and discuss strategies to improve infection control during endodontic procedures.
Keywords: Periapical Periodontitis, Root Canal Disinfection; Treatment Outcome, Unprepared Surface Areas.
Introdución
La lesión perirradicular es una enfermedad inflamatoria de etiología infecciosa (1). Las implicaciones causadas por la persistencia bacteriana en los canales radiculares son de gran importancia en endodoncia, ya que las bacterias juegan un papel importante en la inducción o mantenimiento de la enfermedad después del tratamento (2-4). El éxito de la terapia endodóntica depende del control efectivo de la infección intraradicular y, en este sentido, la preparación químico-mecánica (PQM) juega un papel crucial en la eliminación o, al menos, en la reducción del número de bacterias a niveles compatibles con la reparación tisular (5). La PQM tiene como principales objetivos la limpieza, desinfección y conformación de los canales radiculares con el fin de eliminar todo el tejido pulpar remanente y bacterias, además de crear un espacio adecuado para colocar la obturación y evitar de esta forma posibles reinfecciones (6).
Diversos estudios han demostrado que el principal factor asociado al fracaso del tratamiento endodóntico, caracterizado por la persistencia o aparición de una lesión perirradicular, es la calidad del tratamiento inicial (7-9). Esto significa que el profesional no ha conseguido una adecuada limpieza, conformación y desinfección para mantener o restaurar la salud periapical. Además de las dificultades técnicas para realizar un tratamiento de endodoncia, la compleja anatomía del sistema de canales radiculares (SCR) (Fig. 1) de todos los grupos de dientes representa grandes desafios (10) para el control de la infección
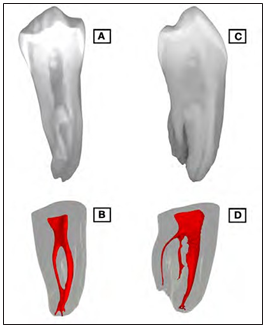
Figura 1. A. Imagen radiográfica de un primer premolar inferior
con cuatro canales. B. micro-CT del diente en A mostrando dos canales vestibulares clase II de Vertucci con presencia de ramificaciones apicales. C. Radiografía del mismo diente en sentido vestíbulo-lingual. D. Estructura interna del diente en C, mostrando dos canales linguales clase IV de Vertucci.
Incluso en el canal principal, una gran cantidad de paredes pueden no ser alcanzadas por los instrumentos utilizados durante la PQM (11-13). Esto sucede debido a factores relacionados con las características del instrumento y/o la anatomía del canal. Por ejemplo, se espera que la preparación con instrumentos finales más pequeños que el diámetro inicial del canal deje más áreas sin preparar (14). En cuanto a la anatomía, una curvatura pronunciada establece una complejidad para la instrumentación, ya que la acción cortante de los instrumentos a lo largo del canal está más concentrada en unas paredes que en otras (15). En consecuencia, es posible que algunas áreas no sean instrumentadas durante los procedimentos endodónticos (16-18).
Diferentes metodologías han sido utilizadas para evaluar los efectos de la PQM. Uno de los enfoques más utilizados para investigar la capacidad de conformación de los instrumentos y técnicas es la Microtomografía Computarizada (micro-CT) (19). Es un método no destructivo que se utiliza para comparar la morfología del canal radicular antes y después de la preparación y el número de paredes no preparadas por los instrumentos. En canales atrésicos y/o circulares, los estudios de micro-CT informaron que diferentes sistemas de instrumentación dejan alrededor del 11% al 48% de la superficie del canal sin preparar (18, 20-22). En cuanto a los canales ovalados/acintados, el número de áreas no instrumentadas varía entre el 8% y el 60% (23-25).
Este artículo describe qué sucede en las áreas que no son instrumentadas después de la PQM, las implicaciones de las bacterias que permanecen en estas superficies y las estrategias para mejorar la limpieza, conformación y la desinfección del canal radicular.
La compleja anatomía del SCR
El diseño de los instrumentos endodónticos tradicionales y el movimiento de instrumentos rotatorios o reciprocantes tiende a preparar el espacio del canal radicular de manera circular, dejando sin instrumentar extensiones vestibulares y lingual/palatinas, lo que favorece la retención de tejidos y restos bacterianos, especialmente en los canales ovalados (26, 27). Es en el canal principal donde se ubican las mayores cantidades de tejido pulpar y, en casos infectados, bacterias, sus productos y subproductos (28, 29).
Sin embargo, el SCR también comprende otras estructuras que representan áreas potenciales para la diseminación de infecciones bacterianas, incluyendo el istmos, canales laterales, ramificaciones apicales y túbulos dentinarios (Fig. 2) (13). Las bacterias que colonizan los canales infectados asociados con la lesión perirradicular primaria o persistente se organizan generalmente en forma de biopelícula adherida a la pared interna del canal radicular (28, 30, 31), así como en áreas de complejidades anatómicas (13, 32-34). Además, las bacterias ubicadas en la parte más profunda de la biopelícula pueden invadir y colonizar la región del túbulo dentinario subyacente (30, 35, 36).
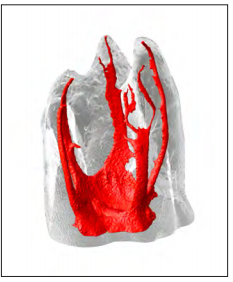
Figura 2. Estructura interna de un 1er molar superior mostrando a través de micro-CT la presencia de cinco canales radiculares con diferentes ramificaciones apicales y canales accesorios.
La invasión bacteriana de los túbulos dentinarios puede ocurrir en aproximadamente el 70-80% de los canales de dientes con lesión perirradicular (35, 37). Aunque la penetración superficial es más común in vivo, se pueden observar células bacterianas que alcanzan aproximadamente 300 μm en algunos dientes (30). Es poco probable que, durante la PQM, se eliminen las células bacterianas ubicadas en las regiones más profundas de los túbulos dentinarios.
La región del istmo es muy común en algunos grupos de dientes, especialmente en los molares inferiores. Por ejemplo, la aparición de un istmo que conecta los canales vestibular y lingual de un molar inferior debe considerarse una regla y no una excepción. Los estudios informan una incidencia de istmo en aproximadamente el 70-88% de los molares mandibulares (34, 38). Al evaluar solo el tercio apical, los autores reportan su presencia hasta en un 80% de los casos (39, 40).
Las ramificaciones, incluidas las laterales, colaterales y apicales, pueden ocurrir en cualquier grupo de dientes y en cualquier región a lo largo de la raíz, sin embargo, son más frecuentes en la porción apical y en los dientes posteriores. (33, 41). En general, se observan ramificaciones en aproximadamente el 75% de los dientes (33). Evaluando específicamente cada segmento del canal radicular, la ocurrencia de ramificaciones se encuentra en 73.5% en el tercio apical, 11% en el tercio medio y 15% en el tercio coronario (42). Sin embargo, debido a la alta frecuencia de ramificaciones, es intrigante porque las lesiones perirradiculares laterales no se ven con tanta frecuencia. Esto puede estar relacionado principalmente con su tamaño y permeabilidad, así como con su condición microbiológica. Entonces, cuanto más amplia es la ramificación, mayor es el espacio para la colonización bacteriana y la acumulación de factores de virulencia (33).
Los estudios morfológicos han relacionado el fracaso del tratamiento endodóntico, caracterizado por la persistencia de la lesión perirradicular, con la presencia de infección en la zona del istmo (28, 31, 43), canales laterales, ramificaciones apicales (28, 44, 45), y túbulos dentinarios (28, 31, 36). De esta forma, la necesidad de un adecuado control de la infección se hace evidente, no solo en la región del canal principal, sino en todo el SCR.
Capacidad de conformación y efectos microbiológicos de la instrumentación
Los objetivos microbiológicos del tratamiento endodóntico de dientes asociados con lesión perirradicular son reducir el número de bacterias a niveles compatibles con la reparación de tejidos y prevenir la recolonización microbiana del canal radicular tratado. (13). Estos objetivos se pueden lograr mediante medidas antimicrobianas que involucren los procedimientos realizados durante la PQM y mediante el uso de medicación intracanal (13, 46). Aunque no parece razonable dar una importancia especial a un procedimiento endodóntico en particular, la PQM puede considerarse un paso esencial en la desinfección del SCR (47). Sin embargo, aunque con menor frecuencia, las bacterias pueden persistir después de finalizado el tratamento, incluso cuando este ha sido realizado con altos estándares de calidad.
Dado que la eliminación microbiana del canal radicular puede considerarse un predictor del resultado final del tratamiento endodóntico (48-50), numerosos estudios han evaluado la eficacia antimicrobiana de diferentes técnicas de preparación y sustancias químicas auxiliares (51-55).
Los estudios que utilizaron soluciones de irrigación sin acción antimicrobiana encontraron que la acción mecánica de la instrumentación y la irrigación fue efectiva para reducir la cantidad de células bacterianas en el canal durante la PQM (47, 56). Sin embargo, en la mayoría de los casos, no se observó una eliminación bacteriana completa.
Ingle y Zeldow (57) en un estudio clínico observó que inmediatamente después de la instrumentación, utilizando solución salina estéril como irrigante principal, el 80% de los casos asociados con la infección produjeron cultivos positivos. Al inicio de la segunda consulta, 48 horas después, ese número aumentó al 95,4%. Byström y Sundqvist
(47) usaron solución salina estéril durante la instrumentación y encontraron que había persistencia bacteriana en aproximadamente la mitad de los casos, a pesar de haber realizado el tratamiento en cinco consultas. Los dientes en los que persistió la infección fueron los que tenían un elevado número de bacterias en la muestra inicial. Siqueira, Lima (58) utilizaron solución salina estéril durante la instrumentación y demostraron que la preparación y la irrigación pueden eliminar mecánicamente más del 90% de las células bacterianas del interior del canal radicular. Sin embargo, aunque fue observada una reducción de la carga microbiana, las bacterias nunca fueron eliminadas por completo de los canales radiculares, independientemente de la técnica y el diámetro del instrumento utilizado.
La presencia de complejidades anatómicas dentro de los canales radiculares puede representar desafíos importantes para obtener una limpieza, desinfección y conformación adecuados (59). Por tanto, durante el tratamiento endodóntico, es fundamental utilizar sustancias químicas auxiliares que tengan acción antimicrobiana, con el fin de optimizar la desinfección.
El irrigante endodóntico más utilizado a nível mundial es el hipoclorito de sodio (NaOCl). Trabajos clínicos (47, 53, 60) y trabajos in vitro (55, 61) han demostrado que su acción química ayuda a incrementar la desinfección intracanal, complementando los efectos mecánicos de la instrumentación.
Siqueira, Rôças (61), en un estudio in vitro, evaluaron la reducción bacteriana producida por la instrumentación e irrigación con NaO-Cl al 1%, 2,5% y 5,25% o solución salina. Los canales radiculares se contaminaron con Enterococcus faecalis y se instrumentaron e irrigaron con las soluciones mencionadas. Las muestras microbiológicas se realizaron antes y después de la PQM. Todos los irrigantes redujeron significativamente la cantidad de células bacterianas presentes dentro del canal radicular, sin embargo, todas las soluciones de NaOCl fueron significativamente más efectivas que la solución salina.
Rodrigues, Zandi (53), en un estudio clínico, evaluaron cuarenta y tres dientes asociados con lesión perirradicular postratamiento y sometidos a retratamiento. Los dientes se dividieron aleatoriamente en 2 grupos según el irrigante utilizado (NaOCl al 2,5% o solución salina) y se observó que el grupo de NaOCl proporcionó una desinfección significativamente mayor que el grupo de solución salina, pero solo cuando se utilizaron instrumentos de mayor diámetro.
Así, aunque los efectos mecánicos son altamente efectivos en la reducción de poblaciones bacterianas, los efectos químicos que aporta una solución de irrigación con acción antimicrobiana son fundamentales para lograr una mejor desinfección durante el tratamiento endodóntico (53).
El uso de NaOCl al 2,5% durante la PQM puede reducir los niveles de bacterias intrarradiculares entre un 95 y un 99% (52, 62, 63). El flujo y reflujo del irrigante, así como el uso de grandes volúmenes de solución, deben mantener la eficacia antibacteriana del NaOCl, compensando los efectos de concentraciones más bajas (61).
La clorhexidina también se ha utilizado durante el tratamiento endodóntico y ha mostrado resultados antimicrobianos comparables a los del NaOCl (54, 62, 64, 65). Aunque se observa una reducción bacteriana significativa mediante la irrigación con NaOCl o clorhexidina asociada con la instrumentación mecánica, aún es posible detectar bacterias en aproximadamente el 23% al 54% de los conductos asociados con lesión perirradicular después de la irrigación con estas soluciones (46, 51, 52, 54, 66, 67).
La ineficacia de los instrumentos y los irrigantes puede resultar en una desinfección inadecuada (59). Cuando el diámetro de la preparación apical es menor, pueden quedar grandes cantidades de bacterias y tejido necrótico después del tratamiento endodóntico (53, 58, 68). Es posible observar que los canales radiculares preparados con instrumentos de menor diámetro dejan mayor área de paredes no instrumentadas (14).
Pérez, Alves (14) evaluaron los efectos del aumento progresivo de la preparación apical sobre la cantidad de paredes del canal radicular no preparadas por micro-CT (Fig.3). Incisivos inferiores ovalados fueron instrumentados con un sistema rotatorio de hasta 4 instrumentos mayores en que el primero que se ajustaba a la longitud de trabajo (LT). Los dientes fueron escaneados por micro-CT antes de preparar el canal y después de la instrumentación con el segundo, tercer y cuarto instrumento de mayor tamaño. Se observó que luego de cada aumento progresivo del diámetro de la preparación, hubo una reducción significativa en el número de áreas no instrumentadas, concluyendo que a mayor preparación apical, mayor número de paredes tocadas por el instrumento.
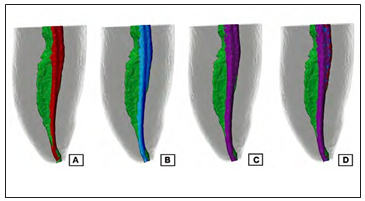
Figura 3. Imágenes microtomográficas de un incisivo central inferior con un canal ovalado después del aumento secuencial del diámetro apical de instrumentación. A. Instrumento 30/04.
B. Instrumento 35/04. C. Instrumento 40/04.
D. Sobreposición de todos los diámetros
Además, los estudios microbiológicos han demostrado que cuanto mayor es la preparación apical, mayor es la reducción bacteriana intraconducto (53, 58, 68-72). Sin embargo, en todos los estudios, todavía se observó persistencia microbiana después de la PQM en algunos casos.
Las complejidades anatómicas, como las curvaturas y las extensiones vestíbulo-linguales y/o palatinos de los canales radiculares ovalados, en forma de C o acintados, pueden influir en el resultado final del tratamiento de endodoncia (59). Además, las bacterias que permanecen en la parte más apical del canal radicular, en los deltas apicales y en los canales laterales podrían causar infecciones residuales de larga duración (6). Los instrumentos de endodoncia actúan principalmente sobre el canal principal y la correcta limpeza, desinfección del istmo y ramificaciones dependen principalmente de los efectos químicos de los irrigantes y la medicación intraconducto (13).
Las bacterias restantes pueden sobrevivir en cantidades suficientes en el SCR y si tienen contacto con los tejidos perirradiculares pueden comprometer el resultado del tratamiento endodóntico (49). Debido a que están estrechamente relacionados con los tejidos apicales, que son una fuente sostenible de nutrientes, las bacterias residuales pueden mantener la inflamación perirradicular y prevenir la reparación completa de los tejidos (6).
Evaluación de la instrumentación del canal radicular a través de la correlación de diferentes métodos
La limpieza, conformación y desinfección del SCR se pueden evaluar mediante diferentes métodos. Los resultados observados se han utilizado con éxito para esclarecer los efectos de los procedimientos realizados durante la PQM, con el objetivo de intentar mejorar los instrumentos, las soluciones de irrigación y las técnicas de preparación a lo largo de los años.
Una de las herramientas utilizadas más recientemente para evaluar la conformación del canal radicular es el micro-CT. Su mayor ventaja es la naturaleza no destructiva, que permite comparar la morfología del canal radicular antes y después de la instrumentación en dientes extraídos (73).
Un parámetro comúnmente evaluado en estos estudios es la cantidad y/o área de superficie del canal radicular no preparado por los instrumentos. Varios estudios han revelado que una cantidad relativamente alta de la superficie del canal principal permanece sin instrumentar, especialmente en canales radiculares curvos u ovalados / acintados, independientemente de los sistemas y técnicas utilizadas. Los estudios que utilizan micro-CT revelaron que aproximadamente entre el 10 y el 50% de las paredes del canal no son alcanzadas por los instrumentos (10, 16, 18-22, 74-80).
Se han planteado hipótesis sobre las implicaciones clínicas de estos hallazgos, debido a la posible persistencia de bacterias en forma de biopelícula, además de tejido pulpar vivo o necrótico en áreas no preparadas con instrumentos endodónticos (18, 78). Sin embargo, también se puede esperar que en estas áreas la solución de irrigación, especialmente el NaOCl utilizado durante la PQM, pueda llegar, limpiar y desinfectar estas paredes, debido a sus efectos antimicrobianos y disolución de materia orgánica. Por tanto, es importante evaluar las condiciones morfológicas de las superficies de los canales no instrumentados, buscando aclarar esta duda. Para ello, es fundamental evaluar estas áreas, combinando diferentes metodologías con los datos e imágenes obtenidos mediante micro-CT.
El estudio de Siqueira, Alves (18) fue el primero en correlacionar los métodos de evaluación por micro-CT y microbiología para evaluar los efectos de la PQM realizada con diferentes sistemas de instrumentación. No encontraron ninguna correlación entre la cantidad de áreas no preparadas y los niveles bacterianos residuales, sin embargo, las condiciones específicas de las paredes no instrumentadas no pudieron evaluarse mediante la metodologia utilizada.
Otro estudio correlacionó micro-CT y análisis microbiológico (78) y evaluó la capacidad de desinfección de un paso complementario a la PQM, comparando la irrigación ultrasónica pasiva (PUI) y el XP-endo Finisher (FKG Dentaire, La Chaux-de-Fonds, Suiza) en los canales mesiales de molares inferiores. A través del análisis de reacción en cadena de la polimerasa (PCR) en tiempo real, se demostró que ambos enfoques complementarios dieron como resultado una pequeña reducción adicional de bacterias, y que fue significativa solo para XP-endo Finisher. Sin embargo, una vez más este tipo de análisis correlativo no reveló una relación estadísticamente significativa entre la reducción bacteriana y el porcentaje de áreas no preparadas. Ninguno de los enfoques probados pudo desinfectar de manera predecible el área del istmo, como lo demostró el enfoque correlativo que utilizó micro-CT, criopulverización y microbiología molecular.
Siqueira, Pérez (19), en un estudio correlativo mediante micro-CT y microscopía (histología y microscopía electrónica de barrido [SEM]) describieron las condiciones morfológicas de las paredes del canal no preparadas con instrumentos endodónticos en dientes con pulpas vitales o necróticas. El análisis histológico de los canales que contenían pulpa vital reveló restos de tejido en las paredes no preparadas, especialmente en el tercio apical del canal radicular. Mientras tanto, los resultados obtenidos a través de SEM mostraron que los canales con pulpas necróticas tenían bacterias y restos necróticos de dentina a lo largo de todas las paredes no preparadas en todos los tercios del canal.
Otro estudio reciente, evaluó la capacidad de limpieza y conformación de 3 sistemas de instrumentación (SAF, TruShape, XP Endo Shaper) con diferentes cinemáticas de instrumentación en canales ovalados, utilizando un enfoque correlativo entre micro-CT e histología (10). No hubo diferencia significativa en la cantidad de áreas no preparadas entre los 3 sistemas de instrumentación, excepto por la comparación entre SAF y XP-endo Shaper en el segmento apical (el primero fue mejor). Así mismo, no hubo diferencia en la capacidad de limpieza, incluso cuando la mitad de las muestras aún presentaban restos pulpares en áreas vestibulares y linguales no instrumentadas.
Estos estudios de correlación han demostrado que las superficies del canal no preparadas y la región del istmo no se limpian y desinfectan de manera predecible mediante irrigación con jeringa / aguja convencional y NaOCl. Sin embargo, la capacidad de las bacterias para persistir en estas áreas e influir en el resultado final del tratamiento endodóntico depende de varios factores conjuntos.
Influencia de la persistencia de bacterias en áreas no preparadas en el resultado final del tratamiento endodóntico
Se ha demostrado que las bacterias juegan un papel fundamental en el mantenimiento o aparición de lesiones perirradiculares después del tratamiento endodóntico (2-4). Para que las bacterias sobrevivan a los procedimientos de desinfección realizados durante el tratamiento y se detecten en las muestras recolectadas, deben adaptarse al microambiente drásticamente alterado (3).
Hay varias estrategias que utilizan las bacterias para sobrevivir dentro del canal radicular tratado. Las bacterias pueden adherirse a las paredes del canal radicular y formar comunidades organizadas en biopelículas, que pueden ser importantes para aumentar la resistencia bacteriana y su persistencia después de procedimientos antimicrobianos intracanal (81). Es probable que las bacterias ubicadas en ramificaciones, istmo y otras irregularidades escapen de los efectos de los instrumentos (debido a limitaciones físicas) y de los irrigantes (debido a las restricciones de tiempo) utilizados durante la PQM (13). La capacidad de algunas bacterias para penetrar en los túbulos dentinarios, a veces en extensiones profundas, también puede permitirles escapar de la acción de instrumentos y sustancias (82, 83). Además, las soluciones químicas utilizadas en endodoncia pueden ser inactivadas por dentina, fluidos tisulares y materia orgánica rápidamente (84), perdiendo su efectividad a largo plazo.
Es importante enfatizar que la adaptación al nuevo microambiente es crucial para que las bacterias residuales provoquen la persistencia de la enfermedad (6). Un cambio importante inducido por el tratamiento está relacionado con una reducción drástica en la disponibilidad de nutrientes (6). El hecho de que la gran mayoría de los dientes tratados endodónticamente asociados con una lesión perirradicular posterior al tratamiento muestran infección intrarradicular (85-87), indica que las bacterias de alguna manera pueden adquirir nutrientes dentro de los canales obturados. Como prácticamente todos los estudios de microfiltración demuestran que ninguna técnica o material de obturación promueve el sellado completo (88), las bacterias residuales pueden obtener nutrientes de la saliva (infiltración coronaria), los fluidos del tejido perirradicular o el exudado inflamatorio (infiltración apical o lateral) (89).
Aunque la mayor parte del tejido pulpar necrótico se elimina durante la PQM, las bacterias resistentes también pueden utilizar estos restos como fuente de nutrientes. El tejido pulpar que no es eliminado puede estar ubicado en las paredes del canal que no han sido instrumentadas, istmos, irregularidades, túbulos dentinarios y canales laterales (11, 12, 90). Aunque es solo una fuente temporal de nutrientes, el tejido pulpar restante puede mantener la supervivencia bacteriana hasta que se establezca una fuente sostenible de nutrientes mediante infiltración apical o coronal, por ejemplo (6). En la mayoría de los dientes asociados con enfermedad postratamiento, las bacterias se localizan en el tercio apical del SCR, generalmente dentro del canal principal, interpuestas entre el material obturador y los tejidos perirradiculares, en áreas no preparadas y en ramificaciones apicales (28, 31, 32). En estas regiones, las bacterias residuales tienen fácil acceso a los nutrientes.
Estrategias para reducir la cantidad de paredes no instrumentadas y/o optimizar la desinfección
Aparentemente, una estrategia lógica para reducir la cantidad de áreas no preparadas es aumentar el tamaño de la preparación apical. Los procedimientos químicomecánicos deben considerarse completos cuando el canal es ampliado a tamaños de instrumentos que sean compatibles con la anatomía y tamaño de la raíz. Un estudio de micro-CT demostró que después de cada aumento en el tamaño de la preparación apical, la cantidad de superficies no preparadas se redujo significativamente (14). Los estudios microbiológicos han revelado que cuanto mayor es el tamaño de la preparación apical de los canales infectados, mayor es la reducción bacteriana intracanal (53, 68, 70). Además, los beneficios antimicrobianos del NaOCl son significativamente más evidentes en preparaciones apicales de gran tamaño (53, 70). Los estudios también han demostrado que cuanto mayor es el tamaño de la preparación apical, mayor limpieza del tercio apical (91, 92). Las preparaciones más amplias también se asocian con un mejor índice de éxito de dientes infectados con periodontitis apical (93, 94).
Es importante señalar que el diámetro de preparación del canal debe ser lo suficientemente amplio en la porción apical para optimizar la desinfección y limpieza y al mismo tiempo no ser excesivamente grande para evitar accidentes (transportaciones o perforaciones) o debilitar la raíz. La ampliación excesiva de la parte coronal del conducto es indeseable y debe ser evitada para no predisponer el diente a fractura (95). Recientemente han sido introducidos instrumentos con conicidad variable decreciente que ayudan a lidiar con este problema, es decir, permiten grandes preparaciones apicales, reduciendo el ensanchamiento coronal innecesario. Otra estrategia que se ha recomendado ampliamente es complementar los efectos de los procedimientos químicomecánicos. Se ha demostrado consistentemente que la aplicación de una medicación entre citas mejora la eliminación bacteriana después de la preparación (13, 70, 96). Se ha recomendado la activación mecánica, sónica o ultrasónica de NaOCl después de la instrumentación. La activación mecánica de NaOCl asociada con un nuevo instrumento complementario, XP-endo Finisher, ha mostrado buenos resultados en términos de mejora de la desinfección (78), pero no consigue desinfectar de forma predecible el área de istmo de los molares (78, 97).
La activación sónica no ha mostrado beneficios antimicrobianos adicionales significativos (98). PUI es probablemente uno de los enfoques complementarios más utilizados para optimizar la desinfección. Los datos de los estudios in vitro sobre PUI no son concluyentes (99-101). Los ensayos clínicos no informaron efectos antibacterianos suplementarios significativos cuando fue comparado con jeringa convencional (102, 103). Además, un estudio clínico de pronóstico no encontró resultados superiores para el tratamiento con PUI (104). Los estudios clínicos sobre el efecto antimicrobiano de uma irrigación final con CHX también han mostrado resultados no concluyentes (46, 105, 106). Hasta ahora, no hay información consistente de estudios clínicos sobre la efectividad antibacteriana de PDT y PIPS. También existen algunas estrategias que sirven como alternativa a los procedimientos químicomecánicos convencionales, como el sistema EndoVac para irrigación con presión negativa y el sistema de ondas multisónicas GentleWave (Sonendo, Laguna Hills, CA, EE. UU.). Un estudio clínico demostró que el sistema EndoVac no mejora significativamente la desinfección en comparación con la irrigación con aguja convencional (107). En cuanto al sistema GentleWave, no hay ningún estudio clínico que evalúe su eficacia antibacteriana.
La colocación de un material de obturación bien adaptado a lo largo de toda la extensión del canal instrumentado, también podría ser una alternativa a las superfícies del canal no preparadas. Se podría esperar que las bacterias sepultadas por el material de obturación en superficies no preparadas puedan sucumbir. En realidad, debido a que ha sido mostrado que la persistencia bacteriana en el canal es un alto factor de riesgo para el fracaso del tratamento endodóntico, el sepultamiento de bacterias no es confiable (48, 108, 109). Además, se han observado bacterias en las paredes del canal en contacto con material de obturación en algunos dientes con periodontitis apical postratamiento (31). Los selladores endodónticos generalmente exhiben algunos efectos antibacterianos discretos, pero solo antes del fraguado (110, 111). Por lo tanto, no se debe esperar que mejoren significativamente la desinfección. Además, debido a que prácticamente ningún material de obturación endodóntico puede promover un sellado antibacteriano predecible del canal radicular (112-114), habrá casos en los que los fluidos tisulares puedan filtrarse en el canal y proporcionar nutrientes a bacterias residuales. No está claro si la filtración ocurre porque no todas las paredes fueron cubiertas con sellador durante los procedimientos de obturación o el sellador se solubilizó con el tiempo, lo que resulta en un espacio en el que los fluidos pueden producir filtración (36). Se debe fomentar mejoras en los materiales de obturación con mejores características fisicoquímicas y actividad antibacteriana. En ese aspecto, hasta el momento tenemos poca información clínica acerca de los materiales hidráulicos (biocerámicos) para la obturación del canal radicular. Dos trabajos recientes no encontraron diferencias significativas en el éxito final del tratamiento cuando fueron comparados con otros cementos en la obturación del SCR (115, 116).
Conclusión
No hay evidencia clínica consistente que demuestre que los enfoques actuales para optimizar la desinfección pueden reducir de manera predecible la carga bacteriana a niveles significativamente por debajo de los logrados por los procedimientos quimícomecánicos convencionales. En general todas las técnicas deben ser sumplementarias a la irrigación e instrumentación del canal y en ningún caso un substituto. Algunos enfoques aún deben probarse. Además de los ensayos clínicos aleatorizados para evaluar el rendimiento de muchos sistemas y protocolos disponibles, también es importante utilizar una correlación de métodos analíticos en estudios ex vivo para evaluar mejor los efectos de limpieza y desinfección de los procedimientos de endodoncia en las paredes del canal no preparadas y áreas de difícil alcance. Se debe fomentar el desarrollo de sistemas, técnicas y estrategias para mejorar la limpieza y desinfección de las paredes del canal radicular con el fin de mejorar el resultado final del tratamento endodóntico.
Referencias Bibliográficas
Roane JB, Sabala CL, Duncanson MG, Jr. The "balanced force" concept for ins-
trumentation of curved canals. J Endod. 1985;11(5):203-11. doi: 10.1016/S0099-
1. Kakehashi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol. 1965;20:340-9. PubMed PMID: 14342926.
2. Rôças IN, Siqueira JF, Jr., Aboim MC, Rosado AS. Denaturing gradient gel electrophoresis analysis of bacterial communities associated with failed endodontic treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;98(6):741-9. doi: 10.1016/S1079210404006183. PubMed PMID: 15583550.
3. Siqueira JF, Jr., Rôças IN. Polymerase chain reaction-based analysis of microorganisms associated with failed endodontic treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;97(1):85-94. doi: 10.1016/S1079210403003536. PubMed PMID: 14716262.
4. Sundqvist G, Figdor D, Persson S, Sjögren U. Microbiologic analysis of teeth with failed endodontic treatment and the outcome of conservative re-treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998;85(1):86-93. PubMed PMID: 9474621.
5. Ørstavik D. Root canal disinfection: a review of concepts and recent developments. Aust Endod J. 2003;29(2):70-4. PubMed PMID: 14655819.
6. Siqueira JF, Jr., Rôças IN. Clinical implications and microbiology of bacterial persistence after treatment procedures. J Endod. 2008;34(11):1291-301 doi: 10.1016/j. joen.2008.07.028. PubMed PMID: 18928835.
7. Tronstad L, Asbjørnsen KD, L., Pedersen I, Eriksen HM. Influence of coronal restorations on the periapical health of endodontically treated teeth. Endod Dent Traumatol. 2000;16(5):218-21. Epub 2001/02/24. PubMed PMID: 11202885.
8. Moreno JO, Alves FR, Gonçalves LS, Martinez AM, Rôças IN, Siqueira JF, Jr. Periradicular status and quality of root canal fillings and coronal restorations in an urban Colombian population. J Endod. 2013;39(5):600-4. doi: 10.1016/j.joen.2012.12.020. PubMed PMID: 23611376.
9. Tavares PB, Bonte E, Boukpessi T, Siqueira JF, Jr., Lasfargues JJ. Prevalence of apical periodontitis in root canal-treated teeth from an urban French population: influence of the quality of root canal fillings and coronal restorations. J Endod. 2009;35(6):810-3. doi: 10.1016/j.joen.2009.03.048. PubMed PMID: 19482176.
10. Lacerda M, Marceliano-Alves MF, Pérez AR, Provenzano JC, Neves MAS, Pires FR, et al. Cleaning and shaping oval canals with 3 instrumentation systems: a correlative micro-computed tomographic and histologic study. J Endod. 2017;43(11):1878- 84. doi: 10.1016/j.joen.2017.06.032. PubMed PMID: 28951035.
11. Siqueira JF, Jr., Araujo MC, Garcia PF, Fraga RC, Dantas CJ. Histological evaluation of the effectiveness of five instrumentation techniques for cleaning the apical third of root canals. J Endod. 1997;23(8):499-502. doi: 10.1016/S0099-2399(97)80309-3. PubMed PMID: 9587319.
12. Walton RE. Histologic evaluation of different methods of enlarging the pulp canal space. J Endod. 1976;2(10):304-11. doi: 10.1016/S0099-2399(76)80045-3. PubMed PMID: 1068207.
13. Vera J, Siqueira JF, Jr., Ricucci D, Loghin S, Fernandez N, Flores B, et al. One-versus two-visit endodontic treatment of teeth with apical periodontitis: a histobacteriologic study. J Endod. 2012;38(8):1040-52. doi: 10.1016/j.joen.2012.04.010. PubMed PMID: 22794203.
14. Pérez AR, Alves FRF, Marceliano-Alves MF, Provenzano JC, Gonçalves LS, Neves AA, et al. Effects of increased apical enlargement on the amount of unprepared areas and coronal dentine removal: a micro-computed tomography study. Int Endod J. 2018;51(6):684-90. Epub 2017/11/08. doi: 10.1111/iej.12873. PubMed PMID: 29112281.
15. Roane JB, Sabala CL, Duncanson MG, Jr. The "balanced force" concept for instrumentation of curved canals. J Endod. 1985;11(5):203-11. doi: 10.
16. Paqué F, Ganahl D, Peters OA. Effects of root canal preparation on apical geometry assessed by micro-computed tomography. J Endod. 2009;35(7):1056-9. doi: 10.1016/j.joen.2009.04.020. PubMed PMID: 19567334.
17. Versiani MA, Leoni GB, Steier L, De-Deus G, Tassani S, Pecora JD, et al. Microcomputed tomography study of oval-shaped canals prepared with the self-adjusting file, Reciproc, WaveOne, and ProTaper universal systems. J Endod. 2013;39(8):1060- 6. doi: 10.1016/j.joen.2013.04.009. PubMed PMID: 23880278.
18. Siqueira JF, Jr., Alves FR, Versiani MA, Rôças IN, Almeida BM, Neves MA, et al. Correlative bacteriologic and micro-computed tomographic analysis of mandibular molar mesial canals prepared by self-adjusting file, reciproc, and twisted file systems. J Endod. 2013;39(8):1044-50. doi: 10.1016/j.joen.2013.04.034. PubMed PMID: 23880274.
19. Siqueira JF, Jr., Pérez AR, Marceliano-Alves MF, Provenzano JC, Silva SG, Pires FR, et al. What happens to unprepared root canal walls: a correlative analysis using micro-computed tomography and histology/scanning electron microscopy. Int Endod J. 2018;51(5):501-8. Epub 2017/02/15. doi: 10.1111/iej.12753. PubMed PMID: 28196289.
20. Markvart M, Darvann TA, Larsen P, Dalstra M, Kreiborg S, Bjørndal L. Micro-CT analyses of apical enlargement and molar root canal complexity. Int Endod J. 2012;45(3):273-81. doi: 10.1111/j.1365-2591.2011.01972.x. PubMed PMID: 22044111.
21. Peters OA, Arias A, Paqué F. A micro-computed tomographic assessment of root canal preparation with a novel instrument, TRUShape, in mesial roots of mandibular molars. J Endod. 2015;41(9):1545-50. doi: 10.1016/j.joen.2015.06.007. PubMed PMID: 26238528.
22. Zhao D, Shen Y, Peng B, Haapasalo M. Root canal preparation of mandibular molars with 3 nickel-titanium rotary instruments: a micro-computed tomographic study. J Endod. 2014;40(11):1860-4. doi: 10.1016/j.joen.2014.06.023. PubMed PMID: 25205262.
23. Paqué F, Balmer M, Attin T, Peters OA. Preparation of oval-shaped root canals in mandibular molars using nickel-titanium rotary instruments: a micro-computed tomography study. J Endod. 2010;36(4):703-7. doi: 10.1016/j.joen.2009.12.020. PubMed PMID: 20307747.
24. Busquim S, Cunha RS, Freire L, Gavini G, Machado ME, Santos M. A micro-computed tomography evaluation of long-oval canal preparation using reciprocating or rotary systems. Int Endod J. 2015;48(10):1001-6. doi: 10.1111/iej.12398. PubMed PMID: 25314154.
25. Versiani MA, Pecora JD, de Sousa-Neto MD. Flat-oval root canal preparation with self-adjusting file instrument: a micro-computed tomography study. J Endod. 2011;37(7):1002-7. doi: 10.1016/j.joen.2011.03.017. PubMed PMID: 21689560.
26. De-Deus G, Souza EM, Barino B, Maia J, Zamolyi RQ, Reis C, et al. The self-adjusting file optimizes debridement quality in oval-shaped root canals. J Endod. 2011;37(5):701-5. doi: 10.1016/j.joen.2011.02.001. PubMed PMID: 21496675.
27. FornariVJ, Silva-SousaYT,Vanni JR, Pecora JD,Versiani MA, Sousa-Neto MD. Histological evaluation of the effectiveness of increased apical enlargement for cleaning the apical third of curved canals. Int Endod J. 2010;43(11):988-94. doi: 10.1111/j.1365- 2591.2010.01724.x. PubMed PMID: 20722756.
28. Ricucci D, Siqueira JF, Jr. Biofilms and apical periodontitis: study of prevalence and association with clinical and histopathologic findings. J Endod. 2010;36(8):1277- 88. doi: 10.1016/j.joen.2010.04.007. PubMed PMID: 20647081.
29. Siqueira JF, Jr., Rôças IN, Rosado AS. Investigation of bacterial communities
associated with asymptomatic and symptomatic endodontic infections by denaturing gradient gel electrophoresis fingerprinting approach. Oral Microbiol Immunol. 2004;19(6):363-70. doi: 10.1111/j.1399-302x.2004.00170.x. PubMed PMID: 15491461.
30. Siqueira JF, Jr., Rôças IN, Lopes HP. Patterns of microbial colonization in primary root canal infections. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;93(2):174-8. Epub 2002/02/28. PubMed PMID: 11862207.
31. Ricucci D, Siqueira JF, Jr., Bate AL, Pitt Ford TR. Histologic investigation of root canal-treated teeth with apical periodontitis: a retrospective study from twenty-four patients. J Endod. 2009;35(4):493-502. doi: 10.1016/j.joen.2008.12.014. PubMed PMID: 19345793.
32. Ricucci D, Siqueira JF, Jr. Apical actinomycosis as a continuum of intraradicular and extraradicular infection: case report and critical review on its involvement with treatment failure. J Endod. 2008;34(9):1124-9. Epub 2008/08/23. doi: 10.1016/j. joen.2008.06.002. PubMed PMID: 18718379.
33. Ricucci D, Siqueira JF, Jr. Fate of the tissue in lateral canals and apical ramifications in response to pathologic conditions and treatment procedures. J Endod. 2010;36(1):1-15. doi: 10.1016/j.joen.2009.09.038. PubMed PMID: 20003929.
34. Nair PN, Henry S, Cano V, Vera J. Microbial status of apical root canal system of human mandibular first molars with primary apical periodontitis after "one-visit" endodontic treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2005;99(2):231-52. Epub 2005/01/22. doi: 10.1016/j.tripleo.2004.10.005. PubMed PMID: 15660098.
35. Peters LB, Wesselink PR, Buijs JF, van Winkelhoff AJ. Viable bacteria in root dentinal tubules of teeth with apical periodontitis. J Endod. 2001;27(2):76-81. doi: 10.1097/00004770-200102000-00002. PubMed PMID: 11491642.
36. Vieira AR, Siqueira JF, Jr., Ricucci D, Lopes WS. Dentinal tubule infection as the cause of recurrent disease and late endodontic treatment failure: a case report. J Endod. 2012;38(2):250-4. doi: 10.1016/j.joen.2011.10.019. PubMed PMID: 22244647.
37. Matsuo T, Shirakami T, Ozaki K, Nakanishi T,Yumoto H, Ebisu S. An immunohistological study of the localization of bacteria invading root pulpal walls of teeth with periapical lesions. J Endod. 2003;29(3):194-200. doi: 10.1097/00004770-200303000-00008. PubMed PMID: 12669880.
38. Estrela C, Rabelo LE, de Souza JB, Alencar AH, Estrela CR, Sousa Neto MD, et al. Frequency of root canal isthmi in human permanent teeth determined by cone-beam computed tomography. J Endod. 2015;41(9):1535-9. doi: 10.1016/j. joen.2015.05.016. PubMed PMID: 26187423.
39. Gu L, Wei X, Ling J, Huang X. A microcomputed tomographic study of canal isthmuses in the mesial root of mandibular first molars in a Chinese population. J Endod. 2009;35(3):353-6. doi: 10.1016/j.joen.2008.11.029. PubMed PMID: 19249594.
40. von Arx T. Frequency and type of canal isthmuses in first molars detected by endoscopic inspection during periradicular surgery. Int Endod J. 2005;38(3):160-8. doi: 10.1111/j.1365-2591.2004.00915.x. PubMed PMID: 15743419.
41. De Deus QD. Frequency, location, and direction of the lateral, secondary, and accessory canals. J Endod. 1975;1(11):361-6. PubMed PMID: 10697487.
42. Vertucci FJ. Root canal anatomy of the human permanent teeth. Oral Surg Oral Med Oral Pathol. 1984;58(5):589-99. PubMed PMID: 6595621.
43. Carr GB, Schwartz RS, Schaudinn C, Gorur A, Costerton JW. Ultrastructural examination of failed molar retreatment with secondary apical periodontitis: an examination of endodontic biofilms in an endodontic retreatment failure. J Endod. 2009;35(9):1303-9. doi: 10.1016/j.joen.2009.05.035. PubMed PMID: 19720237.
44. Ricucci D, Loghin S, Siqueira JF, Jr. Exuberant Biofilm infection in a lateral canal as the cause of short-term endodontic treatment failure: report of a case. J Endod. 2013;39(5):712-8. doi: 10.1016/j.joen.2012.12.008. PubMed PMID: 23611398.
45. Arnold M, Ricucci D, Siqueira JF, Jr. Infection in a complex network of apical ramifications as the cause of persistent apical periodontitis: a case report. J Endod. 2013;39(9):1179-84. doi: 10.1016/j.joen.2013.04.036. PubMed PMID: 23953295.
46. Paiva SS, Siqueira JF, Jr., Rôças IN, Carmo FL, Leite DC, Ferreira DC, et al. Clinical antimicrobial efficacy of NiTi rotary instrumentation with NaOCl irrigation, final rinse with chlorhexidine and interappointment medication: a molecular study. Int Endod J. 2013;46(3):225-33. doi: 10.1111/j.1365-2591.2012.02111.x. PubMed PMID: 22889410.
47. Byström A, Sundqvist G. Bacteriologic evaluation of the efficacy of mechanical root canal instrumentation in endodontic therapy. Scand J Dent Res. 1981;89(4):321-
8. PubMed PMID: 6947391.
48. Fabricius L, Dahlén G, Sundqvist G, Happonen RP, Möller AJ. Influence of residual bacteria on periapical tissue healing after chemomechanical treatment and root filling of experimentally infected monkey teeth. Eur J Oral Sci. 2006;114(4):278-85. doi: 10.1111/j.1600-0722.2006.00380.x. PubMed PMID: 16911098.
49. Sjögren U, Figdor D, Persson S, Sundqvist G. Influence of infection at the time of root filling on the outcome of endodontic treatment of teeth with apical periodontitis. Int Endod J. 1997;30(5):297-306. PubMed PMID: 9477818.
50. Engström B, Lundberg M.The correlation between positive culture and the prognosis of root canal therapy after pulpectomy. Odontol Revy. 1965;16(3):193-203. Epub 1965/01/01. PubMed PMID: 5321744.
51. Rodrigues RC, Antunes HS, Neves MA, Siqueira JF, Jr., Rôças IN. Infection control in retreatment cases: in vivo antibacterial effects of 2 instrumentation systems. J Endod. 2015;41(10):1600-5. doi: 10.1016/j.joen.2015.06.005. PubMed PMID: 26234543.
52. Neves MA, Provenzano JC, Rôças IN, Siqueira JF, Jr. Clinical antibacterial effectiveness of root canal preparation with reciprocating single-instrument or continuously rotating multi-instrument systems. J Endod. 2016;42(1):25-9. doi: 10.1016/j. joen.2015.09.019. PubMed PMID: 26549221.
53. Rodrigues RCV, Zandi H, Kristoffersen AK, Enersen M, Mdala I, Ørstavik D, et al. Influence of the apical preparation size and the irrigant type on bacterial reduction in root canal-treated teeth with apical periodontitis. J Endod. 2017;43(7):1058-63. doi: 10.1016/j.joen.2017.02.004. PubMed PMID: 28483164.
54. Zandi H, Rodrigues RC, Kristoffersen AK, Enersen M, Mdala I, Ørstavik D, et al. Antibacterial effectiveness of 2 root canal irrigants in root-filled teeth with infection: a randomized clinical trial. J Endod. 2016;42(9):1307-13. Epub 2016/07/28. doi: 10.1016/j.joen.2016.06.006. PubMed PMID: 27452293.
55. Siqueira JF, Jr., Rôças IN, Santos SR, Lima KC, Magalhães FA, de Uzeda M. Efficacy of instrumentation techniques and irrigation regimens in reducing the bacterial population within root canals. J Endod. 2002;28(3):181-4. doi: 10.1097/00004770-200203000-00009. PubMed PMID: 12017176.
56. Ørstavik D, Kerekes K, Molven O. Effects of extensive apical reaming and calcium hydroxide dressing on bacterial infection during treatment of apical periodontitis: a pilot study. Int Endod J. 1991;24(1):1-7. PubMed PMID: 1917083.
57. Ingle JI, Zeldow BJ. An evaluation of mechanical instrumentation and the negative culture in endodontic therapy. J Am Dent Assoc. 1958;57(4):471-6. PubMed PMID: 13575076.
58. Siqueira JF, Jr., Lima KC, Magalhães FA, Lopes HP, de Uzeda M. Mechanical reduction of the bacterial population in the root canal by three instrumentation techniques. J Endod. 1999;25(5):332-5. doi: 10.1016/S0099-2399(06)81166-0. PubMed PMID: 10530256.
59. Siqueira JF, Jr., Rôças IN, Marceliano-Alves MF, Perez AR, Ricucci D. Unprepared root canal surface areas: causes, clinical implications, and therapeutic strategies. Braz Oral Res. 2018;32 (suppl 1):e65. Epub 2018/10/27. doi: 10.1590/1807-3107bor-2018.vol32.0065. PubMed PMID: 30365606.
60. Cvek M, Nord C, Hollender L. Antimicrobial effect of root canal debridement in teeth with immature root. Odontol Revy. 1976;27:1–10.
61. Siqueira JF, Jr., Rôças IN, Favieri A, Lima KC. Chemomechanical reduction of the bacterial population in the root canal after instrumentation and irrigation with 1%, 2.5%, and 5.25% sodium hypochlorite. J Endod. 2000;26(6):331-4. doi: 10.1097/00004770-200006000-00006. PubMed PMID: 11199749.
62. Rôças IN, Provenzano JC, Neves MA, Siqueira JF, Jr. Disinfecting effects of rotary instrumentation with either 2.5% sodium hypochlorite or 2% chlorhexidine as the main irrigant: a randomized clinical study. J Endod. 2016;42(6):943-7. doi: 10.1016/j. joen.2016.03.019. PubMed PMID: 27142579.
63. Siqueira JF, Jr., Guimarães-Pinto T, Rôças IN. Effects of chemomechanical preparation with 2.5% sodium hypochlorite and intracanal medication with calcium hydroxide on cultivable bacteria in infected root canals. J Endod. 2007;33(7):800-5. doi: 10.1016/j.joen.2006.11.023. PubMed PMID: 17804315.
64. Siqueira JF, Jr., Rôças IN, Paiva SS, Guimarães-Pinto T, Magalhães KM, Lima KC. Bacteriologic investigation of the effects of sodium hypochlorite and chlorhexidine during the endodontic treatment of teeth with apical periodontitis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007;104(1):122-30. Epub 2007/05/15. doi: 10.1016/j.tripleo.2007.01.027. PubMed PMID: 17499528.
65. Gonçalves LS, Rodrigues RC, Andrade Junior CV, Soares RG, Vettore MV. The effect of sodium hypochlorite and chlorhexidine as irrigant solutions for root canal disinfection: a systematic review of clinical trials. J Endod. 2016;42(4):527-32. doi: 10.1016/j.joen.2015.12.021. PubMed PMID: 26852149.
66. Paiva SS, Siqueira JF, Jr., Rôças IN, Carmo FL, Ferreira DC, Curvelo JA, et al. Supplementing the antimicrobial effects of chemomechanical debridement with either passive ultrasonic irrigation or a final rinse with chlorhexidine: a clinical study. J Endod. 2012;38(9):1202-6. doi: 10.1016/j.joen.2012.06.023. PubMed PMID: 22892736.
67. Paiva SS, Siqueira JF, Jr., Rôças IN, Carmo FL, Leite DC, Ferreira DC, et al. Molecular microbiological evaluation of passive ultrasonic activation as a supplementary disinfecting step: a clinical study. J Endod. 2013;39(2):190-4. doi: 10.1016/j. joen.2012.09.014. PubMed PMID: 23321229.
68. Card SJ, Sigurdsson A, Ørstavik D, Trope M. The effectiveness of increased apical enlargement in reducing intracanal bacteria. J Endod. 2002;28(11):779-83. doi: 10.1097/00004770-200211000-00008. PubMed PMID: 12470024.
69. Dalton BC, Ørstavik D, Phillips C, Pettiette M, Trope M. Bacterial reduction with nickel-titanium rotary instrumentation. J Endod. 1998;24(11):763-7. doi: 10.1016/ S0099-2399(98)80170-2. PubMed PMID: 9855830.
70. Shuping GB, Ørstavik D, Sigurdsson A, Trope M. Reduction of intracanal bacteria using nickel-titanium rotary instrumentation and various medications. J Endod. 2000;26(12):751-5. doi: 10.1097/00004770-200012000-00022. PubMed PMID: 11471648.
71. Rollison S, Barnett F, Stevens RH. Efficacy of bacterial removal from instrumented root canals in vitro related to instrumentation technique and size. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;94(3):366-71. PubMed PMID: 12324795.
72. Mickel AK, Chogle S, Liddle J, Huffaker K, Jones JJ. The role of apical size determination and enlargement in the reduction of intracanal bacteria. J Endod. 2007;33(1):21-3. doi: 10.1016/j.joen.2006.08.004. PubMed PMID: 17185122.
73. Peters OA, Laib A, Gohring TN, Barbakow F. Changes in root canal geometry after preparation assessed by high-resolution computed tomography. J Endod. 2001;27(1):1-6. doi: 10.1097/00004770-200101000-00001. PubMed PMID: 11487156.
74. Peters OA, Schönenberger K, Laib A. Effects of four Ni-Ti preparation techniques on root canal geometry assessed by micro computed tomography. Int Endod J. 2001;34(3):221-30. PubMed PMID: 12193268.
75. Paqué F, Zehnder M, De-Deus G. Microtomography-based comparison of reciprocating single-file F2 ProTaper technique versus rotary full sequence. J Endod. 2011;37(10):1394-7. doi: 10.1016/j.joen.2011.06.031. PubMed PMID: 21924189.
76. Yang G, Yuan G, Yun X, Zhou X, Liu B, Wu H. Effects of two nickel-titanium instrument systems, Mtwo versus ProTaper universal, on root canal geometry assessed by micro-computed tomography. J Endod. 2011;37(10):1412-6. doi: 10.1016/j. joen.2011.06.024. PubMed PMID: 21924193.
77. Gergi R, Osta N, Bourbouze G, Zgheib C, Arbab-Chirani R, Naaman A. Effects of three nickel titanium instrument systems on root canal geometry assessed by microcomputed tomography. Int Endod J. 2015;48(2):162-70. doi: 10.1111/iej.12296. PubMed PMID: 24717063.
78. Alves FR, Andrade-Junior CV, Marceliano-Alves MF, Perez AR, Rocas IN, Versiani MA, et al. Adjunctive Steps for Disinfection of the Mandibular Molar Root Canal System: A Correlative Bacteriologic, Micro-Computed Tomography, and Cryopulverization Approach. J Endod. 2016;42(11):1667-72. Epub 2016/10/30. doi: 10.1016/j. joen.2016.08.003. PubMed PMID: 27641947.
79. Zuolo ML, Zaia AA, Belladonna FG, Silva E, Souza EM, Versiani MA, et al. Micro-CT assessment of the shaping ability of four root canal instrumentation systems in oval-shaped canals. Int Endod J. 2018;51(5):564-71. Epub 2017/07/02. doi: 10.1111/ iej.12810. PubMed PMID: 28667674.
80. Guimarães LS, Gomes CC, Marceliano-Alves MF, Cunha RS, Provenzano JC, Siqueira JF, Jr. Preparation of oval-shaped canals with Trushape and Reciproc systems: a micro-computed tomography study using contralateral premolars. J Endod. 2017;43(6):1018-22. Epub 2017/04/19. doi: 10.1016/j.joen.2017.01.028. PubMed PMID: 28416315.
81. Distel JW, Hatton JF, Gillespie MJ. Biofilm formation in medicated root canals. J Endod. 2002;28(10):689-93. doi: 10.1097/00004770-200210000-00003. PubMed PMID: 12398165.
82. Siqueira JF, Jr., de Uzeda M. Disinfection by calcium hydroxide pastes of dentinal tubules infected with two obligate and one facultative anaerobic bacteria. J Endod. 1996;22(12):674-6. doi: 10.1016/S0099-2399(96)80062-8. PubMed PMID: 9220753.
83. Haapasalo M, Ørstavik D. In vitro infection and disinfection of dentinal tubules. J Dent Res. 1987;66(8):1375-9. Epub 1987/08/01. doi: 10.1177/00220345870660081801. PubMed PMID: 3114347.
84. Haapasalo M, Qian W, Portenier I, Waltimo T. Effects of dentin on the antimicrobial properties of endodontic medicaments. J Endod. 2007;33(8):917-25. doi: 10.1016/j.joen.2007.04.008. PubMed PMID: 17878075.
85. Molander A, Reit C, Dahlen G, Kvist T. Microbiological status of root-filled teeth with apical periodontitis. Int Endod J. 1998;31(1):1-7. PubMed PMID: 9823122.
86. Lin LM, Pascon EA, Skribner J, Gangler P, Langeland K. Clinical, radiographic, and histologic study of endodontic treatment failures. Oral Surg Oral Med Oral Pathol. 1991;71(5):603-11. PubMed PMID: 2047103.
87. Rôças IN, Jung IY, Lee CY, Siqueira JF, Jr. Polymerase chain reaction identification of microorganisms in previously root-filled teeth in a South Korean population. J Endod. 2004;30(7):504-8. PubMed PMID: 15220647.
88. Gutmann JL. Clinical, radiographic, and histologic perspectives on success and failure in endodontics. Dent Clin North Am. 1992;36(2):379-92. Epub 1992/04/01. PubMed PMID: 1572505.
89. Siqueira JF, Jr. Aetiology of root canal treatment failure: why well-treated teeth can fail. Int Endod J. 2001;34(1):1-10. PubMed PMID: 11307374.
90. Zuolo ML, Walton RE, Imura N. Histologic evaluation of three endodontic instrument/preparation techniques. Endod Dent Traumatol. 1992;8(3):125-9. Epub 1992/06/01. PubMed PMID: 1289071.
91. Usman N, Baumgartner JC, Marshall JG. Influence of instrument size on root canal debridement. J Endod. 2004;30(2):110-2. doi: 10.1097/00004770-200402000-00012. PubMed PMID: 14977309.
92. Albrecht LJ, Baumgartner JC, Marshall JG. Evaluation of apical debris removal using various sizes and tapers of ProFile GT files. J Endod. 2004;30(6):425-8. PubMed PMID: 15167472.
93. Saini HR,Tewari S, Sangwan P, Duhan J, Gupta A. Effect of different apical preparation sizes on outcome of primary endodontic treatment: a randomized controlled trial. J Endod. 2012;38(10):1309-15. doi: 10.1016/j.joen.2012.06.024. PubMed PMID: 22980168.
94. Aminoshariae A, Kulild JC. Master apical file size - smaller or larger: a systematic review of healing outcomes. Int Endod J. 2015;48(7):639-47. Epub 2014/08/13. doi: 10.1111/iej.12370. PubMed PMID: 25113106.
95. Rundquist BD, Versluis A. How does canal taper affect root stresses? Int Endod J. 2006;39(3):226-37. doi: 10.1111/j.1365-2591.2006.01078.x. PubMed PMID: 16507077.
96. McGurkin-Smith R, Trope M, Caplan D, Sigurdsson A. Reduction of intracanal bacteria using GT rotary instrumentation, 5.25% NaOCl, EDTA, and Ca(OH)2. J Endod. 2005;31(5):359-63. PubMed PMID: 15851929.
97. Azim AA, Aksel H, Zhuang TT, Mashtare T, Babu JP, Huang GTJ. Efficacy of 4 Irrigation Protocols in Killing Bacteria Colonized in Dentinal Tubules Examined by a Novel Confocal Laser Scanning Microscope Analysis. Journal of Endodontics. 2016;42(6):928-34. doi: 10.1016/j.joen.2016.03.009. PubMed PMID: WOS:000377821200015.
98. Huffaker SK, Safavi K, Spangberg LSW, Kaufman B. Influence of a Passive Sonic Irrigation System on the Elimination of Bacteria from Root Canal Systems: A Clinical Study. Journal of Endodontics. 2010;36(8):1315-8. doi: 10.1016/j.joen.2010.04.024. PubMed PMID: WOS:000280691900007.
99. Huque J, Kota K, Yamaga M, Iwaku M, Hoshino E. Bacterial eradication from root dentine by ultrasonic irrigation with sodium hypochlorite. Int Endod J. 1998;31(4):242-50. PubMed PMID: 9823113.
100. Siqueira JF, Jr., Machado AG, Silveira RM, Lopes HP, de Uzeda M. Evaluation of the effectiveness of sodium hypochlorite used with three irrigation methods in the elimination of Enterococcus faecalis from the root canal, in vitro. Int Endod J. 1997;30(4):279-82. Epub 1997/07/01. doi: 10.1046/j.1365-2591.1997.00096.x. PubMed PMID: 9477814.
101. Alves FRF, Almeida BM, Neves MAS, Moreno JO, Rocas IN, Siqueira JE. Disinfecting Oval-shaped Root Canals: Effectiveness of Different Supplementary Approaches. Journal of Endodontics. 2011;37(4):496-501. doi: 10.1016/j.joen.2010.12.008. PubMed PMID: WOS:000289318600013.
102. Paiva SSM, Siqueira JF, Rocas IN, Carmo FL, Leite DCA, Ferreira DC, et al. Molecular Microbiological Evaluation of Passive Ultrasonic Activation as a Supplementary Disinfecting Step: A Clinical Study. Journal of Endodontics. 2013;39(2):190-4. doi: 10.1016/j.joen.2012.09.014. PubMed PMID: WOS:000314482500009.
103. Rodrigues RCV, Antunes HS, Neves MAS, Siqueira JF, Rocas IN. Infection Control in Retreatment Cases: In Vivo Antibacterial Effects of 2 Instrumentation Systems. Journal of Endodontics. 2015;41(10):1600-5. doi: 10.1016/j.joen.2015.06.005. PubMed PMID: WOS:000362386100003.
104. Liang YH, Jiang LM, Jiang L, Chen XB, Liu YY, Tian FC, et al. Radiographic healing after a root canal treatment performed in single-rooted teeth with and without ultrasonic activation of the irrigant: a randomized controlled trial. J Endod. 2013;39(10):1218-25. doi: 10.1016/j.joen.2013.06.024. PubMed PMID: 24041381.
105. Paiva SSM, Siqueira JE, Rocas IN, Carmo FL, Ferreira DC, Curvelo JAR, et al. Supplementing the Antimicrobial Effects of Chemomechanical Debridement with Either Passive Ultrasonic Irrigation or a Final Rinse with Chlorhexidine: A Clinical Study. Journal of Endodontics. 2012;38(9):1202-6. doi: 10.1016/j.joen.2012.06.023. PubMed PMID: WOS:000308278200009.
106. Zamany A, Safavi K, Spångberg LS. The effect of chlorhexidine as an endodontic disinfectant. Oral surgery, oral medicine, oral pathology, oral radiology, and endodontics. 2003;96(5):578-81. doi: 10.1016/S1079210403001689. PubMed PMID: CN-00458670.
107. Pawar R, Alqaied A, Safavi K, Boyko J, Kaufman B. Influence of an apical negative pressure irrigation system on bacterial elimination during endodontic therapy: a prospective randomized clinical study. J Endod. 2012;38(9):1177-81. doi: 10.1016/j. joen.2012.06.013. PubMed PMID: 22892731.
108. WaltimoT,Trope M, Haapasalo M, Orstavik D. Clinical efficacy of treatment procedures in endodontic infection control and one year follow-up of periapical healing. J Endod. 2005;31(12):863-6. PubMed PMID: 16306819.
109. Heling B, Shapira J. Roentgenologic and clinical evaluation of endodontically treated teeth, with or without negative culture. Quintessence Int Dent Dig. 1978;9(11):79-84. Epub 1978/11/01. PubMed PMID: 397514.
110. Kayaoglu G, Erten H, Alacam T, Orstavik D. Short-term antibacterial activity of root canal sealers towards Enterococcus faecalis. Int Endod J. 2005;38(7):483-8. doi: 10.1111/j.1365-2591.2005.00981.x. PubMed PMID: 15946270.
111. Siqueira JF, Gonçalves RB. Antibacterial activities of root canal sealers against selected anaerobic bacteria. Journal of Endodontics. 1996;22(2):79-80. doi: https:// doi.org/10.1016/S0099-2399(96)80277-9.
112. Siqueira JF, Jr., Rôças IN, Favieri A, Abad EC, Castro AJ, Gahyva SM. Bacterial leakage in coronally unsealed root canals obturated with 3 different techniques. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000;90(5):647-50. Epub 2000/11/15. doi: 10.1067/moe.2000.110412. PubMed PMID: 11077391.
113. Shipper G, Trope M. In vitro microbial leakage of endodontically treated teeth using new and standard obturation techniques. J Endod. 2004;30(3):154-8. Epub 2004/04/02. doi: 10.1097/00004770-200403000-00007. PubMed PMID: 15055433.
114. Khayat A, Lee SJ, Torabinejad M. Human saliva penetration of coronally unsealed obturated root canals. J Endod. 1993;19(9):458-61. doi: 10.1016/S0099-2399(06)80533-9. PubMed PMID: 8263453.
115. Bardini G, Casula L, Ambu E, Musu D, Mercadè M, Cotti E. A 12-month follow-up of primary and secondary root canal treatment in teeth obturated with a hydraulic sealer. Clin Oral Investig. 2020. Epub 2020/09/30. doi: 10.1007/s00784-020-03590-0. PubMed PMID: 32989597.
116. Zavattini A, Knight A, Foschi F, Mannocci F. Outcome of Root Canal Treatments Using a New Calcium Silicate Root Canal Sealer: A Non-Randomized Clinical Trial. J Clin Med. 2020;9(3). Epub 2020/03/19. doi: 10.3390/jcm9030782. PubMed PMID: 32183124; PubMed Central PMCID: PMCPMC7141324.







