Revista Canal Abierto 45 | Caso Clínico
Manejo de dientes no vitales con ápice abierto por alumnos de grado.
Aceptado: 25-01-2022
Páginas 26-32
Liliana Artaza DDS, PHD1 Marisa Rocca DDS1 Virginia Caplán DD1 Camila Díaz Pizzarello1 Sofía Vidal DDS1 Santiago Frajlich DDS1
1 Cátedra de Endodoncia II, Escuela de Odontología, Universidad del Salvador – Asociación Odontológica Argentina (USAL – AOA)
Resumen
Con la pérdida de la vitalidad pulpar en dientes permanentes jóvenes se detiene el desarrollo radicular, dando lugar a dientes con raíces cortas, paredes delgadas y ápice abierto. Los proce- dimientos tradicionales de apexificación con hidróxido de calcio, en múltiples sesiones, presentan resultados exitosos. Sin embargo, la utilización de biocerámicos como barrera apical ha demostrado ser un tratamiento alternativo predecible en una o dos sesiones. El propósito de este reporte de casos clínicos es informar el resultado clínico y radiográfico del tratamiento de apexificación con biocerámicos en cinco dientes no vitales con ápice abierto. Cada uno de los cuatro pacientes fue tratado por alumnos de grado de la Cátedra de Endodoncia II, Universidad del Salvador-Asociación Odontológica Argentina, con la supervisión y ayuda del personal docente.
Palabras clave: Apexificación. Ápice abierto. Biocerámicos; dientes no vitales. Hidróxido de calcio.
Summary
With the loss of pulp vitality in young permanent teeth, the root development stops, leaving teeth with short roots, thin canal walls and open apex. The traditional procedures of apexification with calcium hidroxide, in multiple sessions, shows successful results. However, the introduction of bioceramics use for apical plugs have demostrated being an alternative predictable treatment in one or two sessions. The purpose of this clinical cases report, is to inform about the clinical and radiographical results of the apexification treatment with bioceramics in five non vital teeth with incomplete root development and open apex. Each one of the four patients were treated by degree students of Endodontics II, Del Salvador-Asociación Odontológica Argentina University, by the supervision and support of the professors.
Keywords: Apexification. Bioceramics. Calcium hydroxide. Non vital teeth. Open apex.
Introdución
El tratamiento de dientes permanentes jóvenes con diagnóstico de necrosis pulpar es un desafío endodóntico y restaurador. Cuando la vitalidad pulpar se pierde, la formación de dentina se detiene, dando como resultado un diente con paredes delgadas propenso a fracturarse(1). El canal radicular amplio e infectado no se puede limpiar y desinfectar con un protocolo agresivo con limas endodónticas por la delgadez de sus paredes y la dificultad en la obturación se manifiesta porque el ápice abierto no proporciona una barrera para contener el material de obturación sin invadir los tejidos periodontales (2). Los procedimientos tradicionales de apexificación utilizaban hidróxido de calcio (3), con resultados exitosos (4). Sin embargo, es un procedimiento con ciertos inconvenientes, como la duración del tratamiento, que puede llegar a los 2 años y la necesidad de recolocar el hidróxido de calcio en múltiples sesiones. Durante este período, el diente se restaura temporalmente con riesgo de fractura y recontaminación (4,5). Además, ha sido informado, ex vivo, una reducción en las propiedades mecánicas de la dentina radicular después de la exposición al hidróxido de calcio durante 5 semanas o más (6). En contraposición a estos hallazgos, la experiencia de Kahler y col., realizada en 330 incisivos de cordero, no observó diferencias significativas en cuanto a la probabilidad de fractura por el uso de hidróxido de calcio como medicación intracanal (7).
El agregado de trióxido mineral (MTA) se introdujo en 1993 (8) y ha sido ampliamente estudiado desde entonces. En 1998 se comenzó a comercializar como ProRoot MTA (Tulsa Dental Specialties, Tulsa, USA). Forma parte de una clase de materiales a base de Biocerámicos, también conocidos como cementos reparadores de silicato de calcio. Sus ventajas están relacionadas con sus propiedades fisicoquímicas y biológicas. El MTA es un cemento biocompatible, químicamente estable dentro del entorno biológico, no tóxico, con poder antibacteriano debido a su pH elevado (9) y con buena capacidad de sellado, incluso en presencia de humedad, ya que no sufre contracción (10). Es un cemento bioactivo, tiene la capacidad de formar hidroxiapatita y finalmente crear un enlace entre la denti- na y el material; mediante la liberación de iones de calcio, induce la unión y proliferación celular, en este caso permitiendo la formación de cemento nuevo y ligamento periodontal, condición biológicamente aceptable para el cierre de un ápice abierto (11,12). El MTA se ha utilizado ampliamente como barrera apical en dientes inma- duros no vitales como alternativa a la apexificación con hidróxido de calcio (12,13) y han demostrado que es un procedimiento exitoso y predecible (13,14), ya sea en una sesión (5,14) como en dos sesiones de tratamiento (5,15). Una preocupación acerca de la técnica de tapón apical es si los dientes con paredes dentinarias delgadas son susceptibles a la fractura radicular post tratamiento (16). Algunos estudios han reportado altas tasas de fracasos a corto y largo plazo, principalmente debido a fracturas radiculares(13,17). Otros autores, sobre 69 dientes inmaduros tratados durante un período de 10 años con MTA como barrera apical, con un seguimiento entre 5 -15 años, obtuvieron un 96% de casos reparados y funcionales, sin fracturas radiculares, demostrando que este es un tratamiento viable y predecible para el éxito a largo plazo (1).
Debido a las desventajas que presenta el MTA, que incluyen tiempo de fraguado prolongado, difícil manipulación y pigmentación de la dentina (10,12), se han desarrollado materiales biocerámicos que minimizan esas dificultades (18). En 2009 se introdujo Biodentine™️ (Septodont, Saint-Maur-des-Fossés, Francia), un sustituto de dentina, compuesto principalmente por silicato tricálcico y carbonato de calcio, con óxido de zirconio como radiopacificante. Las principales ventajas sobre el MTA están dadas por el componente acuoso, que contiene cloruro de calcio, que acelera el fraguado (tiempo de trabajo: 12 min.) y policarboxilato modificado, que se usa como agente plastificante, otorgándole mayor viscosidad (18,19). En cuanto a sus propiedades mecánicas y biocompatibilidad, Camilleri y col., han re- portado resultados superiores en comparación al MTA, debido a que se observó una mayor aposición de hidroxiapatita en la superficie de Biodentine cuando se expuso a fluidos tisulares (20). Estas propieda- des biológicas, junto con la buena estabilidad de color (21), lo con- vierten en un material ideal para su uso en la práctica endodóntica. En cuanto a sus desventajas, Biodentine tiene una baja radiopacidad comparado al MTA (18,19).
El propósito de este reporte de casos clínicos es informar el resultado clínico y radiográfico de la técnica de barrera apical con biocerámicos en 4 pacientes con 5 dientes no vitales con ápices abiertos, tratados por alumnos de grado de la Cátedra de Endodoncia II de USAL-AOA, bajo la supervisión del personal docente.
Presentación del Caso Clínico
De acuerdo con los hallazgos clínicos y radiográficos de cada caso, se informó a los pacientes las opciones de tratamiento disponibles (retratamiento endodóntico no quirúrgico con apexificación con biocerámicos, planteándose también la posibilidad de un abordaje quirúrgico, en caso de ser necesario).
Todos los tratamientos fueron realizados con anestesia local y aislamiento absoluto con dique de goma en todas las sesiones. La longitud de trabajo fue determinada con un localizador apical electrónico y siempre confirmada con una radiografía periapical. En todos los casos se realizó una mínima instrumentación con limas tipo K (Dentsply Maillefer, Ballaigues, Suiza), con una ligera acción circunferencial para evitar un mayor debilitamiento de las delgadas paredes dentinarias, junto con abundante irrigación pasiva con hipoclorito de sodio (NaClO) al 2,5%. Al finalizar la primer sesión de tratamiento, la irrigación final se activó con Endoactivator (Dentsply Maillefer, Ballaigues, Suiza) 1 minuto para el EDTA 17% (Farmadental, Argentina) y 30 segundos para el NaClO al 2,5%. Se finalizó con 10 ml de NaClO al 2,5%. Posterior al secado de los canales radiculares con conos de papel estériles, se aplicó medicación intracanal con hidróxido de calcio (Ca(HO)2 (Farmadental Argentina), utilizando como vehículo solución fisiológica. La cavidad de acceso se cerró con Cavit (3M ESPE, USA). En las sesiones posteriores, se eliminó la medicación intracanal con una irrigación de 30 ml de NaClO al 2,5% activada con Endoactivator durante 1 minuto, seguida por 3 ml de EDTA al 17% activado con Endoactivator durante 1 minuto y posteriormente se irrigó con 10 ml de solución fisiológica, previo a la obturación. El biocerámico utilizado en el tercio apical de los canales radiculares, según cada caso, se preparó de acuerdo a las instrucciones del fabricante y se creó un tapón apical de 4 mm de longitud. Se introdujo en la porción apical de los canales radiculares desde la dirección ortógrada con una jeringa de Messing (EndoGun, Medidenta, Woodside, NY), se adaptó a las paredes con un plugger manual previamente calibrado y se confirmó con radiografías periapicales. Por último, se eliminó el exceso de biocerámico del tercio medio y coronario de los canales radiculares irrigando con solución fisiológica y frotando con un micro cepillo, luego se secaron con conos de papel estériles. Se selló la cavidad de acceso en forma provisoria según cada caso.
Caso clínico 1
Paciente masculino de 14 años de edad, con historia de traumatismo a los 11 años en el sector antero-superior que resultó en fracturas coronarias del 1.1 y 2.1. (Fig.1A).
Poco tiempo después del traumatismo fue sometido a tratamiento endodóntico en el 2.1 y el 2.2. En el momento de la consulta el paciente se encontraba asintomático. La prueba de palpación y percusión de los dientes afectados no reveló dolor, tampoco movilidad y el sondaje periodontal estaba dentro de los límites fisiológicos. El examen radiográfico reveló una imagen radiolúcida perirradicular de gran tamaño que comprometía los dientes
2.1 y 2.2. Diagnóstico pulpar, diente con terapia endodóntica previamente realizada. Diagnóstico periapical, Periodontitis Apical Asintomática.(Fig.1B). Frente a las diferentes opciones de tratamiento, los padres del menor se decidieron por un retratamiento endodóntico con apexificación con MTA.
Primera sesión
Se realizó la remoción del material del contenido de los canales radiculares de los dientes 2.1 y 2.2 con limas H (Dentsply Maillefer, Ballaigues, Suiza). Una vez realizada la limpieza y conformación y posteriormente a la irrigación final, se aplicó la medicacion intracanal y se citó al paciente a los 14 días.
Segunda sesión
El paciente tuvo un postoperatorio asintomático. Se retiró la medicación intracanal de ambos dientes. El diente 2.2 se obturó con conos de gutapercha (Meta, Korea) por compactación lateral y AH26 (Dentsply, Sirona) como sellador endodóntico. El diente 2.1 fue obturado en el tercio apical del canal radicular con ProRoot MTA (Dentsply, Tulsa, USA). Durante el atacado final, se realizó demasiada presión con el plugger, provocando una importante sobreobturación del material (Fig.1C). Se completó la obturación endodóntica con gutapercha termoplastificada por inyección con el sistema Ultrafil (Coltene Whaledent) y cemento AH26. Se informó a los padres del paciente lo ocurrido y se indicó realizar una cirugía apical para retirar el MTA extruido.
Seguimiento
Los padres del menor se negaron a realizar el abordaje quirúrgico, por lo que se decidió realizar controles clínico-radiográficos periódicos. El control al año mostró una gran reducción de la lesión perirradicular, estando el paciente asintomático (Fig.1E). A los 6 años se observó una reparación total de la lesión perirradicular con ausencia de signos y síntomas. Se verificó, además, la tolerancia de los tejidos a la sobreobturación con MTA con la presencia de tejido óseo rodeando la misma (Fig.1G). No se observó cambio de color de la corona dentaria (Fig.1H).
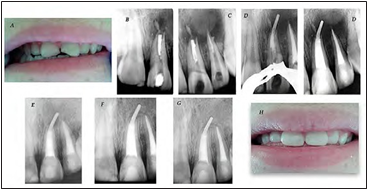
Figura 1. (A) Imagen preoperatoria de un niño de 14 años después de una lesión dental traumática a los 11 años (B y C) Radiografías preoperatorias que muestra una radiolucidez periapical asociado a los dientes 2.1 y 2.2 con tratamientos endodónticos deficientes (D) Sobreobturación accidental
del tapón de MTA. (E) Radiografía postoperatoria que muestra el tratamiento completo con gutapercha inyectada sobre el tapón apical de MTA. (F) El seguimiento de 1 año muestra la disminución de la lesión perirradicular de PA (G) seguimiento a 6 años (H) Cuadro clínico a los 6 años sin cambio de color de la corona en la pieza 2.1.
Caso clínico 2
Paciente femenina de 13 años de edad derivada por el Posgrado de Ortodoncia de USAL-AOA, con antecedente de traumatismo a los 9 años en el sector antero-superior, que resultó en una necrosis pulpar y detención del desarrollo radicular del diente 2.1. Posterior al traumatismo, fue sometida a un tratamiento endodóntico. Por persistencia de síntomas, a los 11 años se le practicó una cirugía y biopsia de la lesión apical, cuyo diagnóstico fue de tejido inflamatorio crónico. En el momento de la consulta, la paciente estaba asintomática. La prueba de palpación arrojó dolor a nivel apical del diente 2.1, sin movilidad y sondaje periodontal dentro de los límites fisiológicos. El examen radiográfico reveló un desarrollo radicular incompleto con el ápice abierto y una endodoncia deficiente con sobrextensión de gutapercha. Además, se observó una imagen radiolúcida perirradicular y agenesia de la pieza 2.2 (Fig.2A). Diagnóstico Pulpar, diente
2.1 con terapia endodóntica previamente realizada. Diagnóstico periapical, Periodontitis Apical Sintomática La opción de tratamiento elegida para el 2.1 fue un retratamiento endodóntico no quirúrgico con apexificación con MTA.
Primera sesión
Se procedió a la remoción del contenido del canal radicular con limas H (Fig. 2B). Una vez realizada la limpieza y conformación (Fig.2C) y posteriormente a la irrigación final, se aplicó medicación intracanal. Se citó al paciente a los 7 días.
Segunda sesión
El paciente tuvo un postoperatorio asintomático, pero se observó un tracto sinuoso vestibular (Fig.2D), cuyo trazado llegaba al ápice de la pieza 2.1 (Fig.2E-2F). Se retiró la obturación provisional y se irrigó con 30 ml de NaClO al 2,5%, activado sónicamente para eliminar el Ca(HO)2 . Se repitió el protocolo de irrigación final y medicación intracanal y se volvió a citar al paciente a los 7 días.
Tercera sesión
La paciente estaba asintomática y el tracto sinuoso cerrado. Se repitieron las maniobras de la segunda sesión para eliminar la medicación intracanal, se secó el canal radicular y se obturó el tercio apical con ProRoot MTA (Fig.2G). Se completó la obturación endodóntica con gutapercha termoplastificada por inyección con el sistema Ultrafil (Coltene Whaledent) y cemento AH26 (Dentsply, Sirona). La pieza fue sellada coronariamente con una restauración plástica con composite (Fig.2H).
Seguimiento
En el control al año, la paciente ya había iniciado el tratamiento de ortodoncia, el diente estaba asintomático y sin cambios de color. Radiográficamente se observó una disminución de la lesión periapical (Fig. 2I-2J). Los controles a los 2 años (Fig. 2K-2L) y a los 3,3 años muestran la reparación de la lesión perirradicular con la formación de una completa cortical ósea rodeando la raíz de la pieza dentaria, estando la paciente asintomática, sin cambios de coloración en la corona y continuando el tratamiento de ortodoncia. (Fig.2M).
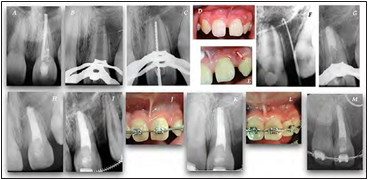
Figura 2. (A) Imagen radiográfica preoperatoria que muestra un tratamiento endodóntico deficiente con sobrextensión de gutapercha en 2.1 y lesión radiolúcida periapical (B)
Radiografía de control posterior al retiro del material intracanal con ápice abierto. (C) conductometría radiográfica con lima tipo K #80 que demuestra la amplitud del CR (D,E y F) En
la 2da sesión la paciente viene con tracto sinusal activo (G) Radiografía postoperatoria que muestra el tapon de MTA
(H) tratamiento completo con gutapercha inyectada sobre el tapón apical de MTA. (I) El seguimiento de 1 año muestra la disminución de la lesión perirradicular de PA (J)Control clínico sin cambio de color (K) seguimiento radiográfico a 2 años (L)
Cuadro clínico a los 2 años sin pigmentación de la corona de la
pieza 2.1. (M) Control radiográfico a los 3,3 años
Caso 3
Paciente femenina de 30 años de edad, derivada por la Cátedra de Integral Adultos de USAL-AOA, que relató haber sufrido a los 9 años un traumatismo con fracturas coronarias de los incisivos centrales superiores y que en diversas oportunidades, posterior al hecho, fueron tratadas por varios odontólogos en la práctica privada, incluida una cirugía apical en el diente 2.1 por presentar un tracto sinuoso persistente. Al momento de la consulta, se observó en ambos dientes 1.1 y 2.1, coronas ceramometálicas deficientes, dolor a la palpación periapical, sin movilidad y sondaje periodontal dentro de los límites fisiológicos. El examen radiográfico reveló tratamientos endodónticos deficientes en raíces cortas con lesiones perirradiculares. En la zona perirradicular del diente 1.1 se visualizó un elemento radiopaco fuera del canal radicular y en el 2.1 se observó un bisel apical producto de la cirugía apical (Fig.3A). Diagnóstico pulpar diente 1.1 y 2.1 con terapia endodóntica previamente realizada. Diagnóstico periapical, Periodontitis apical Sintomática. Frente a repetidos fracasos endodónticos, las opciones de tratamiento eran las exodoncias de ambos dientes y el reemplazo por implantes o el retratamiento ortógrado con colocación de tapón apical con biocerámico. Planteadas las opciones, la paciente optó por realizar los retrata- mientos e intentar salvar los dientes.
Primera sesión
Se eliminaron las coronas y los anclajes intrarradiculares y se adaptaron coronas provisionales. (Fig. 3B y 3C). Se procedió a la remoción de la gutapercha de los canales radiculares con limas H (Fig. 3D) y se realizó la limpieza y conformación (Fig.3E-3F). Finalizada la irrigación final, se colocó la medicación intracanales. Se citó a la paciente a los 7 días.
Segunda sesión
La paciente tuvo un postoperatorio asintomático. Se retiraron las coronas provisionales y se irrigaron ambos canales radiculares para eliminar el Ca(HO)2. El NaClO al 2,5% se empleó en 3 tiempos de 10 ml de solución cada uno, activado con XP-Endo Finisher (FKG, Suiza) a 800 rpm durante 20 seg. Posteriormente, se repitió el procedimiento con 2 ml de EDTA al 17%. Se finalizó la irrigación con 10 ml de solución fisiológica. En el diente
1.1 se utilizó para la obturación apical MTA Cemento Reparador Densell (Dental Medrano, Bs. As., Argentina). En el diente 2.1, el tapón apical se realizó con Biodentine (Septodont, Francia).
A continuación, se colocó una torunda de algodón estéril humedecida con agua destilada en el diente 1.1 y se cementaron las coronas provisionales. En el control radiográfico inmediato se observó una sobreobturación no deseada con Biodentine y la diferencia de radiopacidad entre ambos biocerámicos (Fig. 3G).
Tercera sesión
A los 7 días la paciente estaba asintomática. Se accedió a los canales radiculares y se controló la dureza del tapón de MTA en
1.1 y Biodentine en 2.1.
La paciente continuó su tratamiento en la Cátedra de Odontología Integral Adultos, donde se completó la rehabilitación con postes de fibra y muñones con composite, adaptándose nuevas coronas provisorias (Fig.3H-3I-3J)
Seguimiento
En los seguimientos realizados la paciente estaba asintomática. En el control radiográfico a los 12 meses, se observó un ligero ensanchamiento periodontal en ambos dientes, más marcado en 2.1 (Fig.3K) y estando finalizada la rehabilitación protética (Fig.3L). En el seguimiento a los 3,1 años, ambos dientes estaban asintomáticos, con continuidad del espacio del ligamento periodontal, ausencia de radiolucidez periapical y formación de una cortical ósea rodeando los ápices dentarios y el material sobreobturado (Fig.3M).

Figura 3. (A) Imagen radiográfica preoperatoria (B) Vista clínica una vez removidas las coronas y los anclajes intrarradiculares (C) Adaptación de coronas provisionales
(D) Imagen radiográfica que demuestra la eliminación de la gutapercha (E) Conductometría radiográfica (F)
Conductometría electrónica (G) Control radiográfico inmediato postobturación apical, se observa una sobreobturación del material de obturación no deseada con Biodentine y la diferencia de radiopacidad entre ambos biocerámicos (H) Cementado de los postes de fibra (I) Vista clínica de los muñones de composite (J) Cementado de nuevos provisorios de laboratorio (K) Seguimiento al año con ligero ensanchamiento del ligamento periodontal
(L) imagen clínica de la rehabilitación finalizada (M) Seguimiento radiográfico a 3,1 años.
Caso 4
Paciente femenina de 14 años de edad, que se presentó con dolor agudo a la masticación en diente 4.5. que no presentaba caries ni restauraciones, tampoco antecedentes de traumatismo, pero sí el hábito de morder lapiceras. La evaluación radiográfica mostró un canal radicular amplio con ápice abierto y una lesión perirradicular (Fig.4A). La prueba térmica arrojó resultado negativo, dolor a la palpación periapical y a la percusión, una ligera movilidad y sondaje periodontal dentro de los límites fisiológicos. Diagnóstico pulpar, necrosis. Diagnóstico periapical periodontitis apical sintomática.
Primera sesión
Al realizar la apertura cameral, se observó un drenaje espontáneo de exudado purulento a través del canal radicular, se esperó a que dejara de drenar mientras se irrigaba copiosamente con NaClO al 2,5%. Se realizó la limpieza y conformación (Fig.4B), la activación de la irrigación final y se colocó la medicación intracanal. Se citó al paciente a los 14 días.
Segunda sesión
La paciente tuvo un postoperatorio asintomático. Se retiró la obturación provisional y se irrigó con 30 ml de NaClO al 2,5% activado con Endoactivator para eliminar la medicación intracanal. Se realizó la obturación del tercio apical con MTA Cemento Reparador (Densell, Argentina) (Fig.4C) y el resto del canal radicular se obturó con gutapercha termoplastificada por inyección con el sistema EQV (MetaBioMed, Korea) y AH 26 como sellador. Finalmente, la cavidad de apertura fue sellada coronariamente con una restauración plástica con composite (Fig.4D).
Seguimiento
La paciente siempre estuvo asintomática y sin cambios de coloración. El control radiográfico al año mostró la reparación de la lesión perirradicular (Fig. 4E).
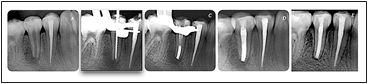
Figura 4. (A) Imagen radiográfica preoperatoria de un niña de 14 años con hábito de morder lapiceras, con lesión perirradicular asociada a pieza 4.5 con ápice abierto
(B) Conductometría radiografica (C) tapón de MTA. (D)
Radiografía postoperatoria que muestra el tratamiento completo con gutapercha inyectada sobre el tapón apical de MTA realizado en la misma sesión operatoria. (E) El seguimiento de 1 año muestra la reparación de lesión perirradicular de periodontitis apical y no se observó cambio de color de la corona dentaria.
Discusión
Tradicionalmente el tratamiento de apexificación se lograba con la aplicación de hidróxido de calcio en mútiples sesiones hasta completar el cierre del extremo radicular (3), técnica con grandes desventajas como la duración del tratamiento y la dificultad de mantener la integridad del sellado coronario (5). La introducción del MTA para su uso en recubrimiento pulpar, pulpotomía, sellado de perforaciones y apexificación, hizo a éste el material de elección por su excelente biocompatibilidad y capacidad de sellado (11).
En un ensayo clínico prospectivo aleatorizado en incisivos necróticos inmaduros (13), se compararon MTA e hidróxido de calcio para inducir el cierre del ápice radicular en incisivos necróticos inmaduros. A los 6 meses no se evidenció diferencias entre ambos materiales, pero a los 12 meses el grupo de MTA mostró un mejor cierre apical. En el grupo de hidróxido de calcio, 4 de 15 dientes exhibieron fracturas coronales o radiculares. En este sentido Tuna y col., (22) sostienen que un tapón de MTA no afecta negativamente la resistencia a la fractura de la dentina.
El control del límite apical durante la colocación de los biocerámicos en canales con ápices abiertos es complejo y conlleva al riesgo de extrusión del material (23). Por esta razón, se ha recomendado la colocación previa de una matriz artificial en el canal radicular, como puede ser el sulfato de calcio (1,2) y el colágeno reabsorbible (24). Sin embargo, en este informe de casos no se utilizó ningún material como barrera reabsorbible. Los hallazgos obtenidos en el mismo mostraron una extrusión de MTA hacia la lesión perirradicular en el caso 1 y con Biodentine en el caso 3. Si bien con ambos biomateriales se observó un adecuado postoperatorio, sin interferencia de su sobreobturación, en el proceso de reparación de la lesión periapical asociada hubiera sido aconsejable el uso de matrices. Pace y col., (14) manifiestan que la sobreobturación con materiales biocerámicos es tolerada por los tejidos perirradiculares y no afecta el proceso de reparación de los mismos. Sin embargo, Nostrat y col., (25) observaron que después de la extrusión de MTA puede ocurrir la curación ósea y la reabsorción del material, o bien puede permanecer sin fraguar y afectar el proceso de curación. En el caso 1 de nuestro estudio, pese a que la extrusión del biocerámico fue importante, se logró una reparación completa de la lesión asociada, ausencia de sintomatología y persistencia de material, con un seguimiento a 6 años.
Diferentes autores recomiendan colocar un algodón humedecido con agua destilada sobre el MTA a fin de asegurar el fraguado y mejorar sus propiedades físicas, realizando la obturación endodóntica final en una segunda sesión (26), teniendo esto como desventaja la posible filtración coronaria entre citas (5). Si bien la presencia de un algodón húmedo en contacto con el MTA acelera el fraguado de la superficie intracanal del material, no influye en el fraguado de su superficie apical (27). En los casos 1, 2 y 4 presentados en este estudio, el espacio del canal radicular coronal al tapón de biocerámico se obturó en la misma sesión con gutapercha inyectada y cemento AH 26. En el caso 3, se cementaron postes de fibra sobre los tapones apicales 7 días posterior a la colocación del tapón de biocerámico.
Materiales biocerámicos como el Biodentine™️ se desarrollaron como alternativa a las desventajas que presenta el MTA (11,18). Se han reportado informes de casos de dientes permanentes jóvenes con ápice abierto tratados con un tapón apical de Biodentine con resultados favorables y un seguimiento a 12 meses (28). En los casos objeto de nuestro estudio, el tiempo medio de seguimiento fue de 3,3 años con un rango de seguimiento de 1 a 6 años.
Consideramos importante que nuestros alumnos se capaciten en la resolución de las diferentes situaciones clínicas a las que nos enfrentamos en la práctica diaria. Mente y col., (23) sugieren la importancia de enseñar a los alumnos la utilización de tapones de MTA para el tratamiento de apexificación. Fong y col., (29) manifiestan que previamente a su graduación los estudiantes de Odontología deben obtener un conocimiento teórico sólido, así como una experiencia clínica adecuada.
En esta experiencia los alumnos, con la supervisación del personal docente, realizaron tratamientos en dientes no vitales con ápice abierto, utilizando 2 cementos biocerámicos reparadores, ambos materiales con similar manipulación. Si bien el MTA tiene una mayor radiopacidad que Biodentine, este último tiene un tiempo de endurecimiento más rápido y no pigmenta la estructura dentaria. El control de la longitud es crítico con ambos materiales, por lo que aconsejamos en la actualidad la utilización de barreras de colágeno reabsorbible. previa a la colocación del tapón de biocerámico.
Referencias Bibliográficas
1. Ree M, Schwartz RS. Long-term success of nonvital, immature permanent in- cisors treated with a mineral trioxide aggregate plug and adhesive restorations: a case series from a private endodontic practice. J Endod 2017;43:1370-77.
2. Trope M. Treatment of immature teeth with non-vital pulps and apical perio- dontitis. Endod Topics 2006;14:51-59.
3. Frank A.L. Therapy for the divergent pulp less tooth by continued apical for- mation. J. Am Dent. Assoc 1966;72:87-93.
4. Cvek M. Prognosis of luxated non-vital maxillary incisors treated with calcium hydroxide and filled with gutta-percha: a retrospective clinical study. Endod Dent Traumatol 1992;8:45-55.
5. Witherspoon DE, Small JC, Regan JD, et al. Retrospective analysis of open apex teeth obturated with mineral trioxide aggregate. J Endod 2008;34:1171–6.
6. Yassen GH, Platt JA. The effect of nonsetting calcium hydroxide on root frac- ture and mechanical properties of radicular dentine: a systematic review. Int En- dod J 2013;46:112–8.
7. Kahler S. L., Shetty S., Andreasen F.M. & Kahler B. The effect of long-term dressing with calcium hydroxide on the fracture susceptibility of teeth. J Endod 2018;44:464-469.
8. Lee S.J, Monsef, M., Torabinejad M. Sealing ability of a mineral trioxide aggre- gate for repair of lateral root perforations. J Endod 1993;19:541-4.
9. Camilleri J, Pitt Ford TR. Mineral trioxide aggregate: a review of the consti- tuents and biological properties of the material. Int Endod J 2006;39:747–754.
10. Parirokh M, Torabinejad M. Mineral trioxide aggregate: a comprehensive li- terature review–part I: chemical, physical and antibacterial properties. J Endod 2010;36:16-7.
11. Bakland LK, Andreasen JO. Will mineral trioxide mineral aggregate replace calcium hydroxide in treating pulpal and periodontal healing complications sub- sequent to dental trauma? a review. Dent Traumatol 2012;28:25-32.
12. Parirokh M, Torabinejad M. Mineral trioxide aggregate: a comprehensive lite- rature review part III: clinical applications, drawbacks, and mechanism of action. J Endod 2010;36:400-13.
13. Bonte E, Beslot A, Boukpessi T, Lasfargues JJ. MTA versus Ca(OH)2 in apexi- fication of non-vital immature permanent teeth: a randomized clinical trial com- parison. Clin Oral Investig 2015;19:1381-8.
14. Pace R, Giuliani V, Nieri M, et al. Mineral trioxide aggregate as apical plug- in teeth with necrotic pulp and immature apices: a 10-year case series. J Endod 2014;40:1250-4.
15. Moore A, Howley MF, O’Connell AC. Treatment of open apex teeth using two types of white mineral trioxide aggregate after initial dressing with calcium hy- droxide in children. Dent Traumatol 2011;27:166-73.
16. Jeeruphan T, Jantarat J, Yanpiset K, et al. Mahidol study 1: comparison of radiographic and survival outcomes of immature teeth treated with either re- generative endodontic or apexification methods: a retrospective study. J Endod 2012;38:1330-6
17. Zanini M, Sautier JM, Berdal A, et al. Biodentine induces immortalized murine pulp cell differentiation into odontoblast-like cells and stimulates biomineraliza- tion. J Endod 2012;38:1220-6.
18. Perard M, Le Clerc J, Meary F, et al. Spheroid model study comparing the bio- compatibility of Biodentine and MTA. J Mater Sci Mater Med 2013;24:1527-34.
19. Laurent P, Camps J, About I. BiodentineTM induces TGF-b1 release from hu- man pulp cells and early dental pulp mineralization. Int Endod J 2012;45:439-48.
20. Camilleri J, Sorrentino F, Damidot D. Investigation of the hydration and bioactivity of radiopacified tricalcium silicate cement, Biodentine and MTA An- gelus. Dent Mater 2013;29:580-93.
21. Vallés M, Roig M, Duran-Sindreu, Martinez S, and Mercade M F, Bouet al. Co- lor stability of teeth restored with Biodentine: A 6-month In vitro study. J Endod 2013;41:1157-1160.
22. Tuna EB, Dinc ̧ol ME, Genc ̧ay K, et al. Fracture resistance of immature teeth filled with Bio aggregate, mineral trioxide aggregate and calcium hydroxide. Dent Traumatol 2011;27:174-8.
23. Mente J, Hage N, Pfefferle T, et al. Mineral trioxide aggregate apical plugs in teeth with open apical foramina: a retrospective analysis of treatment outcome. J Endod 2009;35:1354-8.
24. Haapasalo M, Parhar M, Huang X, Wei X, Lin J & Shen Y. Clinical use of bioce- ramic materials. Endod Topics 2015, 32, 97–117
25. Nostrat A, Nekoofar MH, Bolhari B & Dummer PMH. Unintentional extrusion of mineral trioxide aggregate: a report of three cases. Int Endod J 2012;45:1165- 1176.
26. Giuliani V, Baccetti T, Pace R, Pagavino G. The use of MTA in teeth with necro- tic pulps and open apices. Dent Traumatol 2002;18:217-21.
27. Esmoris M, Artaza L, Goldberg F. Effect of moisture on the setting of MTA. ‘In vitro’ study. Rev Asoc Odontol Argent. 2014;102:115-119.
28. Nayak G, Hasan MF. Biodentine: a novel dentinal substitute for single visit apexification. Restor Dent Endod 2014;39:120-5.
29. Fong W., Heidarifar O., Killough S., M. J. Lappin M.J.,I. El Karim I.A. An audit on technical quality of root fillings performed by undergraduate students . Int Endodon J 2018;51:197-203.







