Revista Canal Abierto 47 | Artículo Científico
Ultrasonido vs. limas Xp-endo Finisher® para remoción de pasta de hidróxido de calcio intracanal.
Resumen
El objetivo de este estudio fue comparar la eficacia de dos sistemas, ultrasonido y XP-endo Finisher®, en la eliminación de una pasta medicamentosa intracanal a base de hidróxido de calcio Ca(OH2) preparada con dos vehículos distintos. Se seleccionaron 36 dientes, los que aleatoriamente se dividieron en 4 grupos, según la preparación de la pasta intracanal y sistema de eliminación: Grupo A: hidróxido de calcio, usando propilenglicol como vehículo, el cual fue retirado mediante técnica ultrasónica. Grupo B: hidróxido de calcio, usando suero fisiológico como vehículo, retirado mediante técnica ultrasónica. Grupo C: hidróxido de calcio, usando propilenglicol como vehículo, retirado con Xp-Endo Finisher®. Grupo D: hidróxido de calcio, usando suero fisiológico como vehículo, retirado con Xp-Endo Finisher®. La cantidad de pasta remanente en los canales fue cuantificada mediante radiografía digital. Al comparar la cantidad de pasta remanente de Ca(OH2) mezclada con propilenglicol, las muestras tratadas con Xp-endo Finisher® presentaron una significativa menor cantidad de medicación respecto a aquellas tratadas con ultrasonido (p=0,048). No hubo diferencias significativas entre el método ultrasónico y Xp-endo Finisher® al cuantificar la pasta remanente de Ca(OH2) mezclada con suero. El sistema Xp-endo Finisher® fue significativamente más eficaz que el uso de ultrasonido en la eliminación de una pasta medicamentosa de Ca(OH2) mezclada con propilenglicol.
Abstract
The aim of this study was to compare the efficacy of two systems, ultrasonic and XP-endo Finisher®, in the removal of the intra-root canal calcium hydroxide (Ca(OH)2) based paste prepared with two different vehicles. Thirty-six teeth were selected and randomly divided into four groups according to the preparation of the root canal paste and the removal system: Group A: calcium hydroxide, using propylene glycol as vehicle, which was removed by ultrasonic technique. Group B: calcium hydroxide, using saline solution as vehicle, removed by ultrasonic technique. Group C: calcium hydroxide, using propylene glycol as vehicle, removed with Xp-Endo Finisher®. Group D: calcium hydroxide, using saline as vehicle, removed with Xp-Endo Finisher®. The amount of paste remaining in the canals was quantified by digital radiography. When comparing the amount of Ca(OH)2 paste remaining mixed with propylene glycol, the samples treated with Xp-Endo Finisher® showed a significantly lower amount of medication than those treated with the ultrasonic method (p=0.048). There was no significant difference between the ultrasonic method and Xp-endo Finisher® when quantifying the remaining Ca(OH)2 paste mixed with saline. The Xp-endo Finisher® system was significantly more effective than the ultrasonic method in the removal of a Ca(OH)2 paste mixed with propylene glycol.
Introdución
En presencia de necrosis pulpar, todo el sistema de canales radiculares se encuentran contaminados por microorganismos y sus productos (Midena et al. 2015). La eliminación de estos se realiza con una adecuada preparación biomecánica y soluciones de irrigación. Dado las limitaciones de ambas, es necesario el uso de un medicamento intracanal para continuar el proceso de descontaminación (Midena et al. 2015).
La pasta medicamentosa de hidróxido de calcio (Ca(OH2)) ha sido usada por décadas por los clínicos como una terapia complementaria a la desinfección del sistema de canales radiculares, basados principalmente en sus propiedades antimicrobianas y promovedoras de la reparación tisular (Martinho et al. 2015; Ozcelik et al 2000). Su mecanismo de acción se basa en la disociación de iones calcio e hidroxilo que aumentan el pH ambiental de los tejidos, inhibiendo el crecimiento bacteriano y favoreciendo los procesos de reparación tisular (Martinho et al. 2015; Midena et al. 2015). Contribuye además a la reducción de los niveles de citoquinas (Th1/Th2) (Chou et al. 2014;Nagas et al. 2016) e hidroliza la fracción lipídica de los lipopolisacáridos (Segato et al. 2016).
Sin embargo, es difícil remover esta pasta medicamentosa en su totalidad, antes de realizar la obturación. La persistencia de este material podría comprometer el sellado del canal, dificultando el proceso de quelación de algunos cementos usados durante la obturación radicular. Por esto, es fundamental generar un canal de paredes limpias apto para ser obturado, para asegurar el éxito final de la terapia (Balvedi et al. 2010; Leoni et al. 2016; Nagas et al. 2016; Rodig et al. 2011; Yucel et al. 2013). Actualmente, esta problemática plantea dos interrogantes principales. Una de ellas se refiere a la influencia que podría tener el tipo de vehículo usado en la mezcla del Ca(OH2), pues es sabido que la combinación de Ca(OH2) con un vehículo acuoso (suero) genera una liberación rápida de iones, solubilizándose en los tejidos (Abi-Rached et al. 2014; Lins et al. 2015). En cambio, un vehículo viscoso (propilenglicol) disminuye la solubilidad de la pasta y prolonga su liberación iónica (Balvedi et al. 2010; Lins et al. 2015). Por otro lado, la técnica y/o los instrumentos utilizados para la remoción de este material desde los canales, podrían tener un efecto determinante. En la actualidad los métodos sónicos y ultrasónicos son los más reconocidos por su capacidad de eliminación del contenido intracanal (Abi-Rached et al. 2014; Balvedi et al. 2010; Lins et al. 2015; Ozcelik et al. 2000).
La activación mediante método ultrasónico proporciona una potente herramienta (Boutsioukis et al. 2010d; Kahn et al. 2000; Van der Sluis et al., 2006) que permite potenciar la acción del irrigante, la desinfección del sistema de canales y de igual forma la eliminación de la medicación intracanal. Sin embargo, algunos estudios han reportado que su uso no es eficiente a nivel del tercio apical (Leoni et al. 2016; Silva et al. 2015).
En la actualidad, existe un instrumento cuyas propiedades físicas ofrecen una mejora sustantiva en la limpieza intracanal. debido a su capacidad de eliminar dentina contaminada y desorganizar el biofilm sin comprometer el tejido sano o la forma original del canal. Gracias a su alta elasticidad, esta lima puede alcanzar un estrecho contacto con las paredes de los canales, logrando abarcar un mayor porcentaje de superficies. XP-endo Finisher® fue creado con una aleación de níqueltitanio Max Wire, con capacidad de deformarse y recuperar su forma frente a los cambios de temperatura, especialmente diseñado para complementar la preparación quimio-mecánica y eliminar todos los restos necróticos presentes en las irregularidades anatómicas donde los instrumentos e irrigantes no logran llegar (FKG, 2015).
Existe escasa evidencia científica acerca de la efectividad de Xp-endo Finisher® y la comparación de resultados con el método ultrasónico, gold standard en términos de activación. El objetivo de este trabajo fue comparar la efectividad en la remoción de una pasta medicamentosa a base de hidróxido de calcio de dos sistemas (ultrasónico y Xp-endo Finisher®), cuando esta fue preparada utilizando dos vehículos distintos.
Materiales y Métodos
Selección de la muestra
Se seleccionaron premolares unirradiculares recién extraídos por motivos periodontales, ortodóncicos o rehabilitadores de pacientes atendidos en servicios dentales públicos, privados y/o universitarios. Los pacientes donantes firmaron un consentimiento informado donde se entrega toda la información respecto al estudio junto a una carta de donación. Ambos documentos, así como la metodología del estudio, fueron aprobados por el Comité de Ética Científica de la Facultad Ciencias de la Salud de la Universidad de Talca, Chile (REG 302016MContardo).
El tamaño muestral se determinó en base a un diseño factorial considerando 30 grados de libertad en el error. De acuerdo a esto, se necesitaron 36 dientes (W. Cochran y G. Cox, Experimental Design, de la Wiley año 1957). Los criterios de inclusión para los dientes a utilizar fueron: canal radicular único, sin calcificaciones pulpares, formación radicular completa, sin fractura radicular y ausencia de rizálisis.
Preparación de las muestras
Los dientes se almacenaron por un periodo máximo de 30 días post exodoncia en un recipiente de vidrio con solución de cloruro de sodio al 0.9%. Posteriormente, se colocaron en una solución de hipoclorito de sodio (NaOCl) al 5%, por 24 horas. La eliminación de tártaro y tejidos blandos de la superficie radicular se realizó con jacquette 30-33 o 31-32 y curetas Gracey n°3 y 4 (Hu-Friedy, Germany).
Posteriormente se realizó la eliminación de la corona, en el límite amelocementario con una fresa de diamante 0.10 de alta velocidad, estandarizando una longitud de trabajo de 13 mm y la numeración e identificación de cada raíz.
Preparación del canal radicular
La longitud de trabajo se determinó restando 1 mm a la longitud obtenida con una lima K (Dentsply Maillefer, Suiza) calibre 10, la que pasó transapicalmente para determinar la longitud real del diente (Kaya et al., 2015). La preparación de los canales se realizó con limas Mtwo, siguiendo las indicaciones del fabricante, hasta una preparación 30/.05 (VDW GmbH, Múnich, Alemania).
La irrigación durante la instrumentación se realizó con jeringa Monoject (Covidien, Dublín, Irlanda) con 1 ml de NaOCl al 5% entre el recambio de limas y con 5 ml de NaOCl al 5% por 1 minuto al finalizar la secuencia de limas (Kovac et al. 2011). Para secar los canales se utilizó conos de papel estériles (Kaya et al., 2015).
Medicación intracanal
En las 36 muestras se utilizó hidróxido de calcio dispensado en cápsula (Hertz, Chile), empleando aleatoriamente como vehículo: a) propilenglicol (n=18) (Merck, Germany) o b) suero fisiológico (n=18), a los cuales se les añadió partículas de yodoformo (Hertz, Chile) hasta obtener una mezcla homogénea y de consistencia condensable. La adición de este componente fue para aumentar la radiopacidad para su posterior evaluación imagenológica. Esta mezcla contenía una determinada cantidad de polvo y de vehículo medida en una balanza digital de precisión (Mettler Toledo, Suiza) y en una proporción de 2:1 en relación a la cantidad de hidróxido de calcio y yodoformo.
La pasta de hidróxido de calcio obtenida se introdujo dentro de los canales con un léntulo n°25 de 21 mm, con tope de silicona a 1 mm de la longitud de trabajo (Dentsply Maillefer, Suiza). Los excesos fueron eliminados con un algodón humedecido con suero. El acceso coronal se selló con vidrio iónómero convencional (KetacTM Molar, 3M).
Posteriormente, y en base a la técnica de remoción de la pasta medicamentosa a la colocación de la pasta dentro de los canales, las muestras fueron divididas en cuatro grupos:
- Grupo A: Correspondiente a 9 dientes, cuya pasta medicamentosa fue hidróxido de calcio y propilenglicol, retirado con insertos ultrasónicos.
- Grupo B: Correspondiente a 9 dientes, cuya pasta medicamentosa fue hidróxido de calcio y suero, retirado con insertos ultrasónicos.
- Grupo C: Correspondiente a 9 dientes, cuya pasta medicamentosa fue hidróxido de calcio y propilenglicol, retirado con Xp-Endo Finisher®.
- Grupo D: Correspondiente a 9 dientes, cuya pasta medicamentosa fue hidróxido de calcio y suero fisiológico, retirado con Xp-Endo Finisher®.
La determinación de la longitud de trabajo, preparación quimio-mecánica y colocación de la pasta medicamentosa en los canales radiculares se realizó por un operador previamente entrenado. La conformación de los grupos se realizó mediante muestreo aleatorio simple. Las raíces se mantuvieron en un ambiente seco y libre de humedad por un período máximo de 7 días.
Retiro del hidróxido de calcio
Transcurridos 7 días, se retiró la medicación. Previo a ello, se utilizó una lima N°25 en todas las muestras, con solución de irrigación, repasando con la última lima rotatoria Mtwo 30/.05, que correspondió a la última lima utilizada en la preparación quimiomecánica, con el fin de remover mayor cantidad de medicación antes de los instrumentos de prueba.
Las muestras de los grupos A y B fueron intervenidas con insertos IRRI Safe #25/.00 (VDW, Múnich Alemania) usando el equipo Ultra (VDW, Múnich Alemania) a una potencia de 20 Hertz. La punta del ultrasonido se colocó a 2 mm menos de la longitud de trabajo, procurando no tocar las paredes del canal, en bloques de 15 segundos hasta alcanzar un tiempo total de 1 minuto, alternando con irrigación y aspiración constante con NaOCl al 5%, con un volumen total de 6 ml.
En los grupos C y D se utilizó limas Xp-endo Finisher® (FKG; Suiza) y un motor Silver ReciprocR (VDW, Múnich Alemania), de acuerdo al protocolo definido por el fabricante. La lima se usó en 4 bloques de 15 segundos hasta completar 1 minuto. Se trabajó a longitud de trabajo, con la cámara inundada en hipoclorito, a una velocidad de 900 rpm y torque de 1 Ncm, en constante movimiento y pincelando las paredes del canal. Se introdujo sin rotar, recta y se retiró en movimiento. Al finalizar se irrigó profundamente para eliminar residuos.
Radiografía con método de contraste
La evaluación de todas las muestras fue hecha con radiografía digital. Estas imágenes fueron tomadas con placas de fósforo para radiografía retroalveolar #2 (Air Techniques; New York, USA) con un tiempo de exposición de 0.16 segundos. El equipo radiográfico usado (ENDOS AC/ACP; Buccinasco) con 70 Kv y 8 mA. Las imágenes fueron digitalizadas en un equipo VistaScan (Dürr Dental, Múnich Alemania).
Para la toma de las radiografías se utilizó un posicionador de técnica paralela. Cada muestra fue posicionada dentro un tubo eppendorf de 1,5 ml,. Esta posición fue registrada con una marca, tanto en el tubo como en la superficie de la raíz con un marcador permanente (Sharpie), trazando una línea vertical en la cara vestibular de la raíz y en la zona externa del tubo (Figura 1), las que debieron coincidir, tanto en la toma radiográfica inicial como en la final. La distancia entre el tubo de rayos y las muestras fue de 8 cm. Igualmente, la posición y angulación del brazo del equipo fueron estandarizadas.

Figura 1. Sistema para posicionar las muestras para la toma radiográfica inicial y final
Las imágenes obtenidas fueron procesadas en el software ImageTool 3.0, con el cual se realizó la cuantificación del contenido inicial y remanente de Ca(OH2) en el interior del canal. La marcación y localización de un sistema de puntos alternados permitió la demarcación de un área, correspondiente en cada muestra a la zona en donde permanecía la pasta medicamentosa, observada gracias a la radiopacidad entregada por el iodoformo. Estas áreas fueron medidas 3 veces y se calculó promedio y desviación estándar de cada una.
Análisis Estadístico
Se utilizó un diseño factorial de 2x2, para comparar la eficacia entre dos sistemas en la eliminación de la pasta medicamentosa intracanal preparada con dos vehículos distintos. Para el diseño, los factores corresponden a:
- Instrumentos: Ultrasonido y Xp-endo Finisher®.
- Vehículos: Suero y propilenglicol.
Se revisaron los supuestos estadísticos (Shapiro Wilk y Levene) y se consideró un nivel de significancia de 5%. Los datos fueron analizados en el Software estadístico Infostat y SPSS 15.0 para Windows.
Para determinar la influencia del método de retiro y el vehículo, sobre la eliminación de Ca(OH2) intracanal, se analizó la normalidad de los datos y dado su distribución se utilizó T de Student para poblaciones independientes en cada caso.
Resultados
En la tabla 1 se observa el porcentaje, promedio y desviación estándar de superficies que persistían con medicación luego de la aplicación de cada método cuando se utilizó propilenglicol en la mezcla.
Cuando se compara la cantidad de pasta remanente de hidróxido de calcio mezclada con propilenglicol, se observa que las muestras tratadas con Xp-endoFinisher® presentaron una significativa menor cantidad de medicación comparadas con aquellas que fueron tratadas con ultrasonido (valor p=0,048). Figura 2. Figura 3 y Figura 4.
En la tabla 2 se observa el porcentaje, promedio y desviación estándar de superficies que persistían con medicación luego de la aplicación de cada método cuando se utilizó suero en la mezcla.
Tabla 1. Porcentaje, promedio y desviación estándar de superficies que persistían con medicación luego de la aplicación de cada método cuando se utilizó propilenglicol en la mezcla.
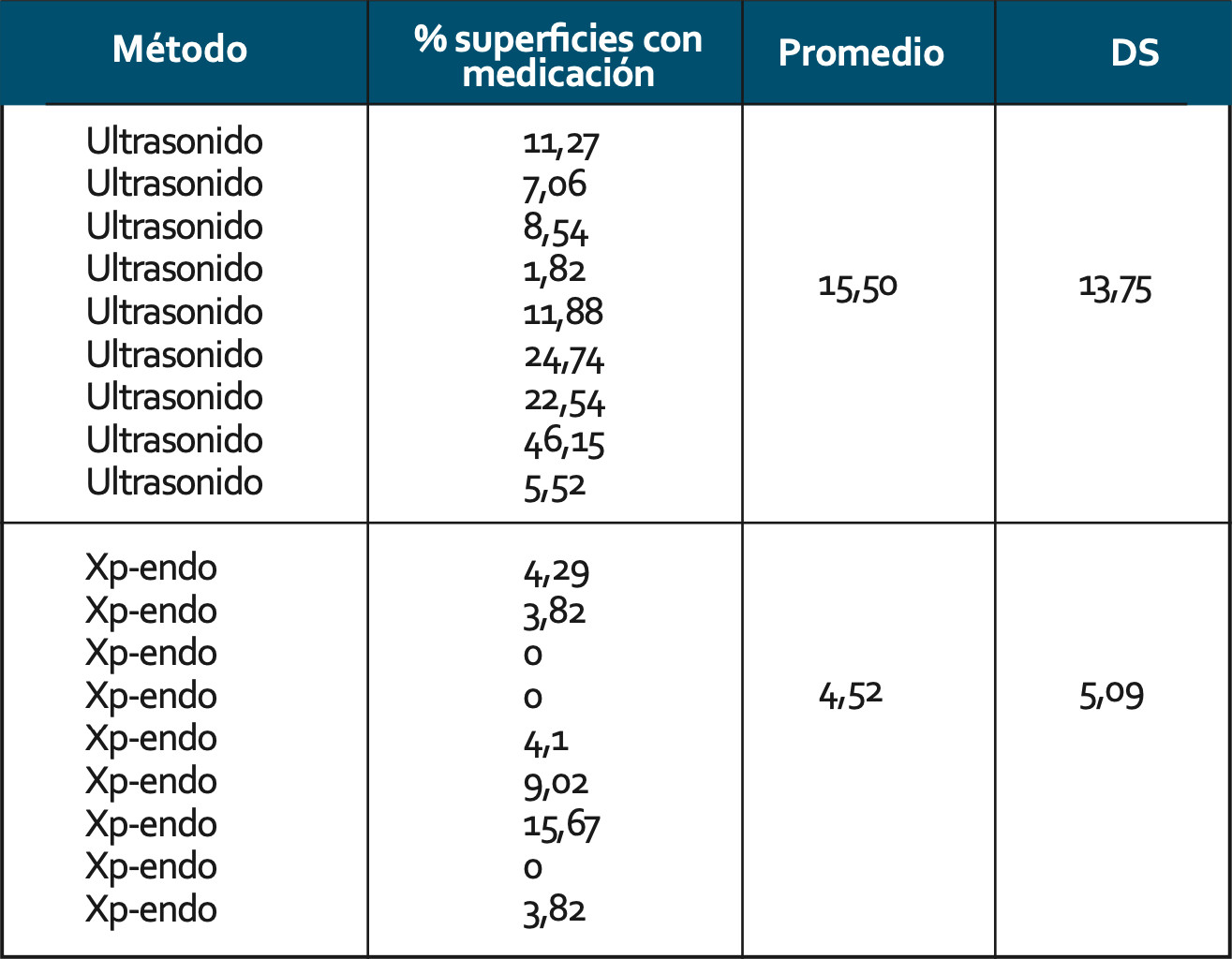
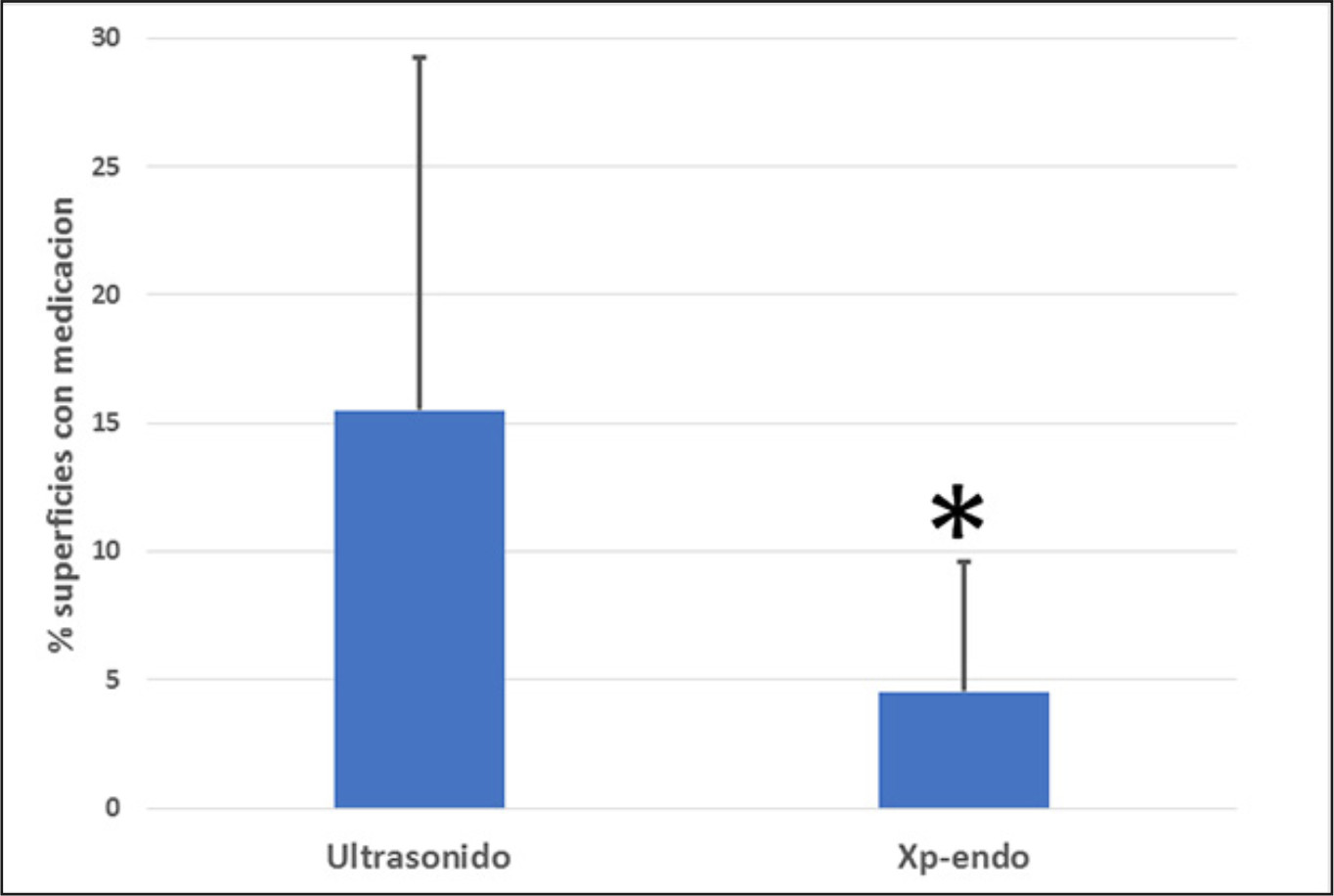
Figura 2. Promedio y desviación estándar de superficies que persistían con medicación luego de la aplicación de cada método cuando se utilizó propilenglicol en la mezcla.
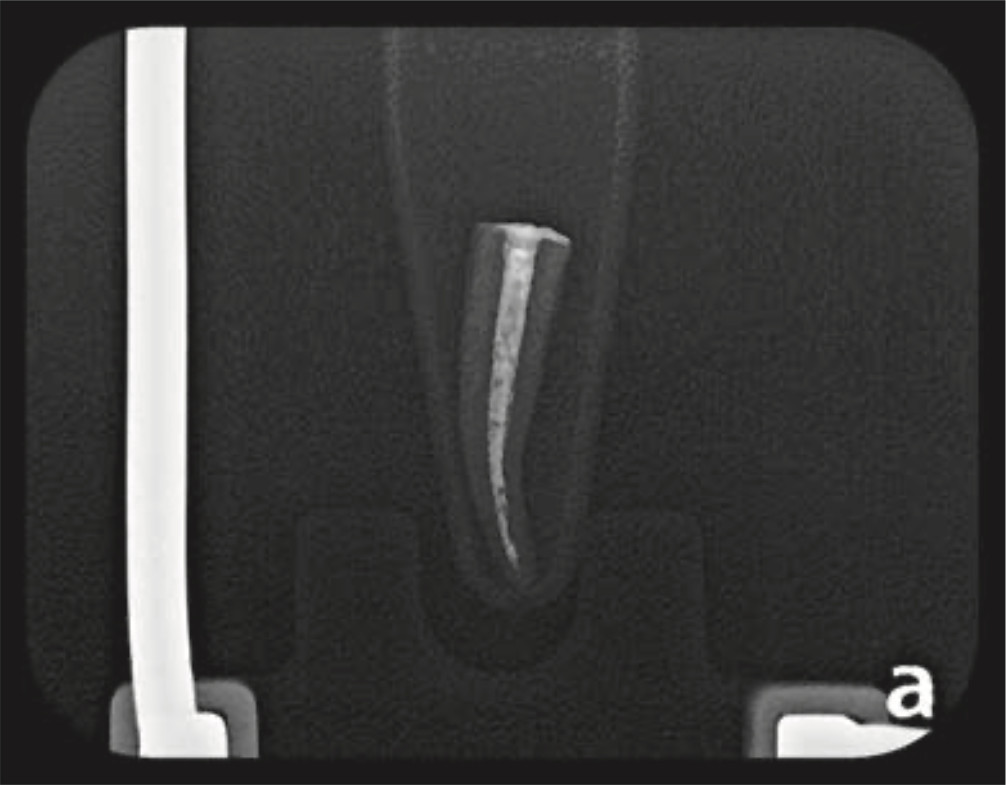
Figura 3a. Radiografía de canal radicular con mezcla de hidróxido de Calcio y propilenglicol.
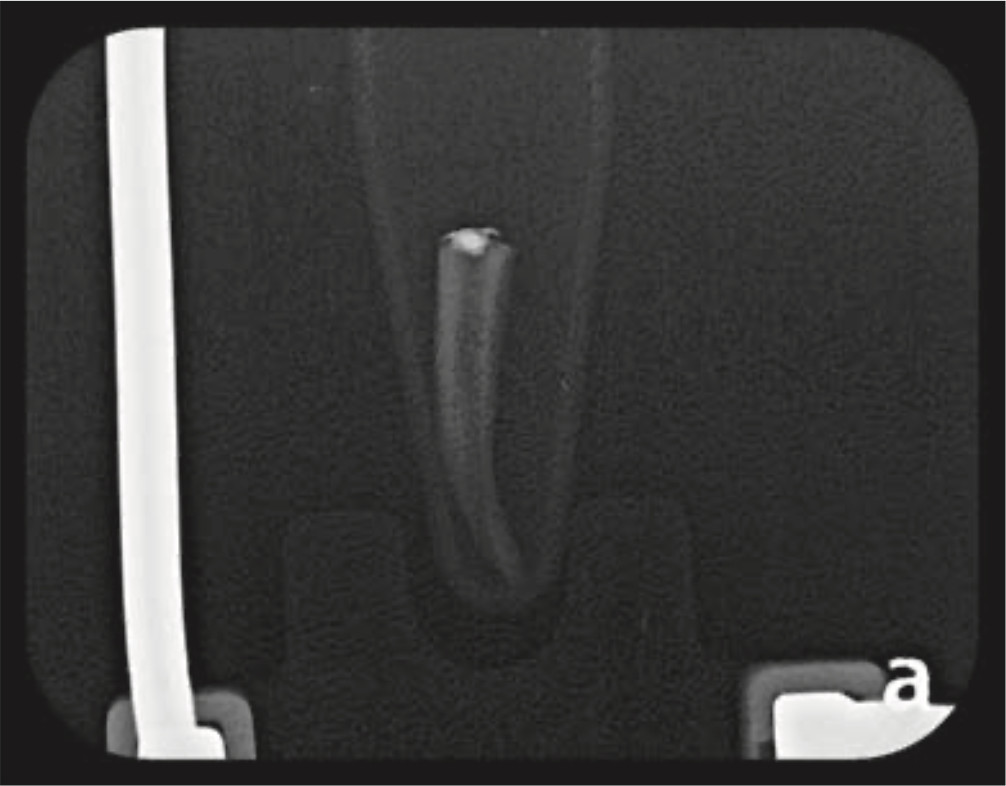
Figura 3b. Radiografía de canal radicular posterior al uso de Xp-endoFinisher®
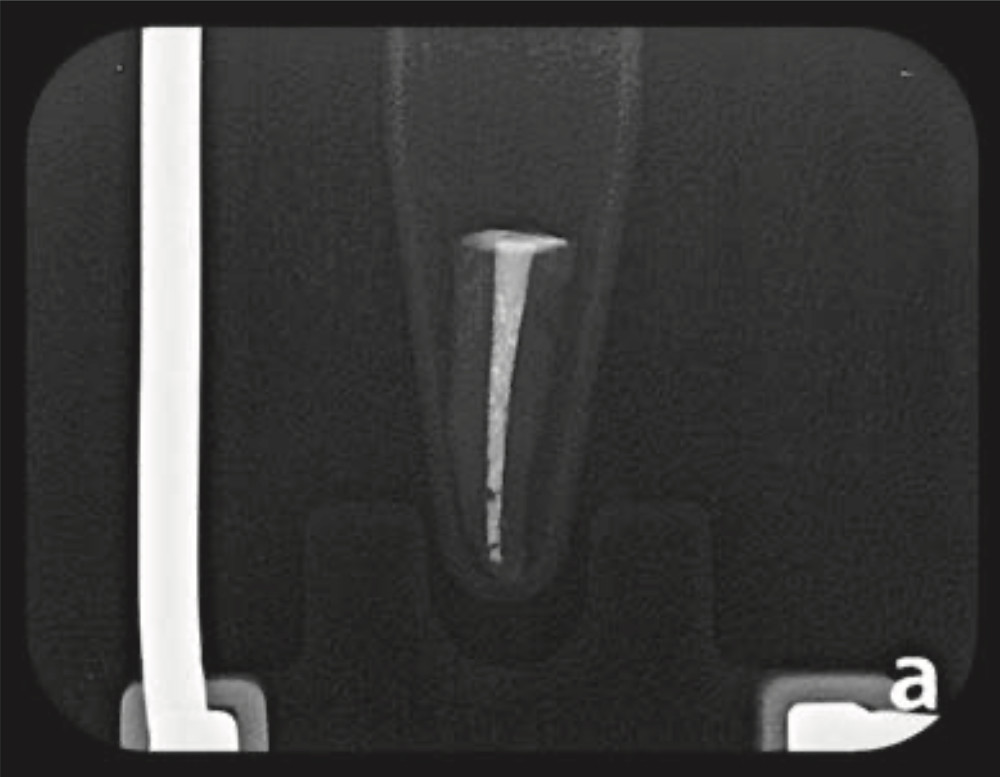
Figura 4a. Radiografía de canal radicular con mezcla de hidróxido de Calcio y propilenglicol.
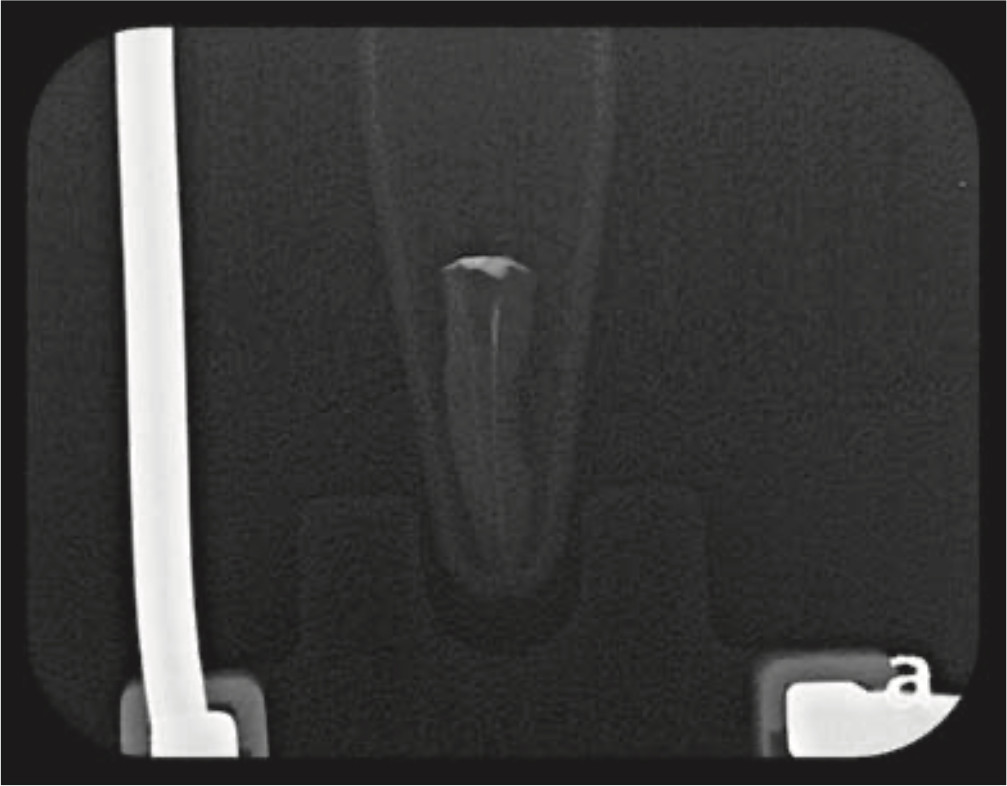
Figura 4b. Radiografía de canal radicular posterior al uso de ultrasonido.
Cuando se comparó la cantidad de pasta remanente de hidróxido de calcio mezcladas con suero, se pudo ver que no hubo diferencias estadísticamente significativas entre el método ultrasónico y Xp-endo Finisher® (p=0,302). Figura 5.
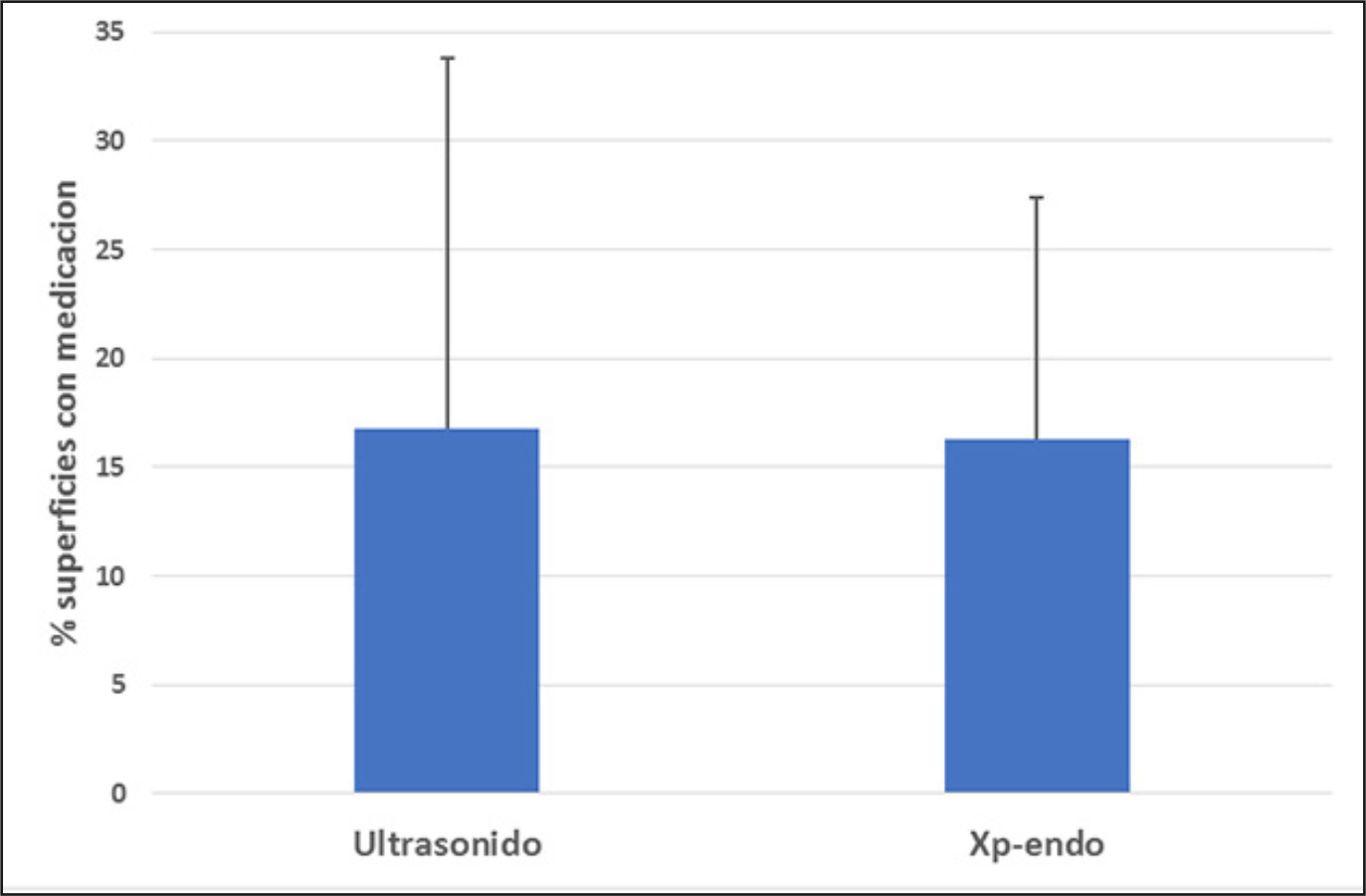
Figura 5. Promedio y desviación estándar de superficies que persistían con medicación luego de la aplicación de cada método cuando se utilizó suero en la mezcla.
Discusión
La obtención de superficies limpias y libres de contenido orgánico o restos de materiales en los canales radiculares, es fundamental para asegurar un correcto sellado durante la obturación radicular (Lins et al. 2015). La presencia de material contaminado puede dificultar el proceso de quelación de algunos cementos selladores usados en endodoncia (Nagas et al. 2016), lo que hace fundamental contar con todos los elementos que nos permitan limpiar correctamente la superficie interna de los canales. Sin embargo, la remoción de cualquier residuo puede ser muy difícil dada las características antómicas de los canales y la dificultad para acceder a esas irregularidades, tanto con las limas como con la solución de irrigación (Mohammadi, 2011; Siqueira at al. 1999). De igual forma, la eliminación total de una pasta medicamentosa puede ser una tarea difícil de lograr. Por este motivo, el ultrasonido ha sido ampliamente usado en las últimas décadas para mover e impulsar la solución irrigante dentro de los canales. Su utilización ha sido incluida en los protocolos de preparación quimio-mecánica (Blank-Gonçalves et al., 2011; Gu et al., 2009; Khaleel et al., 2013; Mancini et al., 2013). En este estudio, se pudo observar que tanto ultrasonido como lima p-endo Finisher® retiraron gran parte de la pasta medicamentosa presente en los canales, pero no lograron eliminarla en su totalidad. Esta se concentraba en la zona apical y paredes laterales, tal como lo relata la literatura, donde prácticamente todas las muestras analizadas presentan restos de medicación, principalmente a nivel apical (Lins et al, 2015; Silva et al 2015).
Por otro lado, la literatura describe que el tipo de vehículo usado en la mezcla podría influir en la eliminación de este del sistema de canal y que en general los vehículos acuosos presentan mayor solubilidad (Abi-Rached et al. 2014; Balvedi et al. 2010; Lins et al. 2015).
Sin embargo, al analizar los resultados obtenidos en este estudio, se evidenció que el grupo de raíces tratadas con XP-endo Finisher® presentó un menor porcentaje de superficies con medicación remanente, respecto al grupo tratado con ultrasonido, solo cuando la medicación fue hecha a partir de hidróxido de calcio y propilenglicol. Cuando se utilizó suero en la mezcla de la medicación, no hubo diferencias significativas entre ambos métodos.
Los resultados podrían asociarse a la incorporación de partículas de yodoformo a la mezcla, que si bien según lo revisado en la literatura no afectan las propiedades del material (Buldo et al. 2013; Kuga et al. 2015), durante la etapa experimental la mezcla con suero generó una consistencia poco condensable y difícil de llevar a la raíz mediante léntulo, la cual endurecía rápidamente dentro del canal. Por lo mismo, se sugiere determinar si la asociación de ambos materiales (suero y yodoformo) afectaría la estabilidad o propiedades de la pasta medicamentosa.
Al analizar la distribución de las zonas con restos de medicación en el caso del ultrasonido, se observan principalmente a nivel del tercio apical y paredes laterales, tal como se evidenció en un estudio con micro CT (Silva et al. 2015), en donde la medicación tendió a acumularse a nivel apical por la fuerza realizada durante el procedimiento de extracción del material (Lambrianidis et al., 2006), la inserción limitada de la punta de irrigación a 1,5 o 2 mm de la longitud de trabajo, quedando esta zona sin el efecto directo de la activación ultrasónica (Nandini et al., 2006, Wiseman et al. 2011). Sumado a lo anterior, la morfología cónica de los canales radiculares con un pequeño diámetro en apical que genera mayores dificultades durante la irrigación (Kenee et al., 2006, Balvedi et al., 2010) y la presión negativa que se genera en la zona apical del canal que impide una adecuada limpieza (Plotino et al. 2007; Rengo et al. 2000; Rodig et al. 2011).
En el caso de XP-endo Finisher® , la distribución de zonas con restos de medicación es principalmente a nivel de las paredes laterales, lo cual podría indicar que existen zonas del canal que no logran ser tocadas por el instrumento. Los autores de este estudio sugieren la realización de investigaciones posteriores, en las cuales se evalúe la eficacia del uso de ultrasonido para la limpieza del canal, y se complemente con Xp-endo, a modo de alcanzar una limpieza más eficiente en todas las zonas del canal. Lo anterior podría modificar los actuales protocolos de irrigación y activación usados en la preparación quimio-mecánica.
En cuanto al método radiográfico, se prefirió el uso de radiografía digital, pues desaparece el uso de líquidos reveladores y fijadores, que se ven afectados por la temperatura ambiental y el uso reiterado de los materiales (Lavelle, 2005). Cabe destacar que para eliminar sesgos, las radiografías fueron tomadas siempre en la misma posición y bajo las mismas condiciones, utilizando el dispositivo adaptado para el estudio.
Para estandarizar las muestras, se seleccionaron premolares unirradiculares mandibulares, dado la anatomía radicular y sección transversal de estos (Riffo, 2008). Estas fueron estandarizadas a 13 mm para eliminar variables como longitud de trabajo, anatomía y disposición de la muestra (Turker, Uzunoğlu, & Sağlam, 2015).
Finalmente, tanto el método ultrasonido, como la lima Xp-endo Finisher® retiraron gran parte de la pasta medicamentosa presente en los canales, sin embargo no lograron eliminarla en su totalidad, aunque, Xp-endo Finisher®, dadas sus características de fabricación, obtuvo diferencias significativas en la eliminación de la medicación cuando esta se realizó con propilenglicol.
Conclusión
- El sistema Xp-endo Finisher® fue significativamente más eficaz que el uso de ultrasonido en la eliminación de una pasta medicamentosa de hidróxido de calcio mezclada con propilenglicol, desde conductos radiculares.
- Cuando fue usado suero para la mezcla de hidróxido de calcio, ambos sistemas fueron igualmente eficaces en la eliminación desde los canales radiculares, pero no hubo diferencias significativas.
Referencias Bibliográficas
1. Abi-Rached GP, Herrera DR, Zaia AA, Ferraz CC, Almeida JF, Gomes BP. 2014. Efficacy of ethylene-diamine-tetra-acetic acid associated with chlorhexidine on intracanal medication removal: A scanning electron microscopy study. Microsc Res Tech. 77(9):735-739.
2. Alves, F. R. F., Rocas, I. N., Almeida, B. M., Neves, M. A. S., Zoffoli, J., & Siqueira, J. F., Jr. 2012. Quantitative molecular and culture analyses of bacterial elimination in oval-shaped root canals by a single-file instrumentation technique. International Endodontic Journal, 45(9), 871-877.
3. Athanassiadis B, Abbott PV, Walsh LJ. 2007. The use of calcium hydroxide, antibiotics and biocides as antimicrobial medicaments in endodontics. Aust Dent J 52(1 Suppl):S64-82.
4. Balvedi RP, Versiani MA, Manna FF, Biffi JC. 2010. A comparison of two techniques for the removal of calcium hydroxide from root canals. Int Endod J. 43(9):763-768.
5. Barbosa CA, Gonçalves RB, Siqueira JF, De Uzeda M. 2000. Evaluation of the antibacterial activities of calcium hydroxide, chlorhexidine, and camphorated paramonochlorophenol as intracanal medicament. A clinical and laboratory study. J Endod 23(5):297-300.
6. Blank-Gonçalves LM, Nabeshima CK, Martins GH, Machado ME. 2011. Qualitative analysis of the removal of the smear layer in the apical third of curved roots: conventional irrigation versus activation systems.J Endod 37(9):1268-1271.
7. Boutsioukis, C., Gogos, C., Verhaagen, B., Versluis, M., Kastrinakis, E., & Van der Sluis, L. W. 2010a.The effect of root canal taper on the irrigant flow: evaluation using an unsteady Computational Fluid Dynamics model. Int Endod J, 43(10), 909-916.
8. Boutsioukis, C., Gogos, C., Verhaagen, B., Versluis, M., Kastrinakis, E., & Van der Sluis, L. W. 2010b. Evaluation of Irrigant Flow in the Root Canal Using Different Needle Types by an Unsteady Computational Fluid Dynamics Model Int Endod J, Volume 36, Number 5. 43(10), 909-916.
9. Boutsioukis, C., Gogos, C., Verhaagen, B., Versluis, M., Kastrinakis, E., & Van der Sluis, L. W. 2010c. The effect of apical preparation size on irrigant flow in root canals evaluated using an unsteady Computational Fluid Dynamics model. International Endodontic Journal, 43, 874–881.
10. Boutsioukis, C., Gogos, C., Verhaagen, B., Versluis, M., Kastrinakis, E., & Van der Sluis, L. W. 2010d.The Effect of Needle-insertion Depth on the Irrigant Flow in the Root Canal: Evaluation Using an Unsteady Computational Fluid Dynamics Model Int Endod J, Volume 36, Number 10, 43(10), 909-916.
11. Boutsioukis,C, Psimma, Z & Van der Sluis, LW. 2013. Factors affecting irrigant extrusion during rootcanal irrigation: a systematic review. Int Endod J.
12. Buldo Mauro, Elverdin JC, Fernández-Solari J ,Rodríguez P. 2013.
Evaluation of the antiseptic power of Grossman cement combined with Iodoform on different bacterial strains found in infections of endodontic origin. Cátedra de Endodoncia1 y Cátedra de Fisiología2, Facultad de Odontología, UBA. 13. Chou K, George R, Walsh LJ. 2014. Effectiveness of different intracanal irrigation techniques in removing intracanal paste medicaments. Aust Endod J. 40(1):21-25.
14. Chugal, N. M., Clive, J. M., & Spångberg, L. S. 2003. Endodontic infection: some biologic and treatment factors associated with outcome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 96(1), 81-90.
15. Dultra, F., Barroso, J. M., Carrasco, L. D., Capelli, A., Guerisoli, D. M., & Pécora, J. D. 2006. Evaluation of apical microleakage of teeth sealed with four different root canal sealers. J Appl Oral Sci, 14(5), 341-345.
16. Farhad A, Mohammadi Z. 2005. Calcium hydroxide: a review. Int Dent J 55(5):293-301.
17. Fava L. 2007. Periapical Radiographic Techniques During EndodomticDiagnosis and Treatment. Int. Endod J., núm. 30, pp. 250-261.
18. Fava LR, Saunders WP . 1999. Calcium hydroxide pastes: classification and clinical indications. Int Endod J 32(4):257-282.
19. Ferrara, G., Taschieri, S., Corbella, S., Ceci, C., Del Fabbro, M., & Machtou, P. 2015. Comparative evaluation of the shaping ability of two different nickel-titanium rotary files in curved root canals of extracted human molar teeth.J Investig Clin Dent.
20. Ferreira F, Adeodato C, Barbosa I, Aboud L, Scelza P, Scelza MZ. 2016. Movement kinematics and cyclic fatigue of niti rotary instruments: A systematic review. Int Endod J.
21. Forsberg, F. 2000. Periapical Raduiolucencies as Evaluated by BisectingAngle and Paralleling Radiographic Techniques, Int. Endod. J., núm. 30, pp. 115-123. 22. Gambarini G, Gergi R, Naaman A, Osta N, Al Sudani D. 2012. Cyclic fatigue analysis of twisted file rotary niti instruments used in reciprocating motion. Int Endod J. 45(9):802-806.
23. Gomes BP, Ferraz CC, Vianna ME, Berber VB, Teixeira FB, Souza-Filho FJ . 2001. In vitro antimicrobial activity of several concentrations of sodium hypochlorite and chlorhexidine gluconate in the elimination of Enterococcus faecalis. Int Endod J 34(6):424-428.
24. Gomes BP, Ferraz CC, Vianna ME, Rosalen PL, Zaia AA, Teixeira FB et al. 2002. In vitro antimicrobial activity of calcium hydroxide pastes and their vehicles against selected microorganisms. Braz Dent J 13(3):155-161.
25. Gu LS, Kim JR, Ling J, Choi KK, Pashley DH, Tay FR. 2009. Review of contemporary irrigant agitation techniques and devices. J Endod 35(6):791-804.
26. Haapasalo M, Shen Y, Qian W, Gao Y. 2010. Irrigation in endodontics. Dent Clin North Am 54(2):291-312.
27. Jeansonne MJ, White RR . 2004. A comparison of 2.0% chlorhexidine gluconate and 5.25% sodium hypochlorite as antimicrobial endodontic irrigants. J Endod 20(6):276-278.
28. Kahn FH, Rosenberg PA, Gliksberg J. 2000. An in vitro evaluation of the irrigating characteristics of ultrasonic and subsonic handpieces and irrigating needles and probes. J Endod 21(5):277-280.
29. Kaya, S., Yiğit Özer, S., Adigüzel, Ö., Oruçoğlu, H., Değer, Y., Tümen, E. C., & Uysal, İ. 2015. Comparison of apical microleakage of dual-curing resin cements with fluid-filtration and dye extraction techniques. Med Sci Monit, 21, 937-944. 30. Kenee DM, Allemang JD, Johnson JD, Hellstein J, Nichol BK. 2006. A quantitative assessment of efficacy of various calcium hydroxide removal techniques. J Endod 32(6):563-565.
31. Kersten, H. W., Wesselink, P. R.,& Thoden van Velzen, S. K. 2000. The diagnostic reliability of the buccal radiograph after root canal filling. Int Endod J, 20(1), 20-24. 32. Khaleel HY, Al-Ashaw AJ, Yang Y, Pang AH, Ma JZ. 2013. Quantitative comparison of calcium hydroxide removal by EndoActivator, ultrasonic and ProTaper file agitation techniques: an in vitro study. J Huazhong Univ Sci Technolog Med Sci 33(1):142-145.
33. Klyn SL, Kirkpatrick TC, Rutledge RE. 2010. In vitro comparisons of debris removal of the EndoActivator system, the F file, ultrasonic irrigation, and NaOCl irrigation alone after hand-rotary instrumentation in human mandibular molars. J Endod 36(8):1367-1371.
34. Kovac J, Kovac D. 2011. Effect of irrigating solutions in endodontic therapy. Bratisl Lek Listy 112(7):410-415.
35. Kuga, M. C., Faria, G., SÓ, M. V., Keine, K. C., dos Santos, A. D., Duarte, M. A. H., &Kopper, P. M. P. 2014. The impact of the addition of iodoform on the physicochemical properties of an epoxy-based endodontic sealer. Journal of Applied Oral Science, 22(2), 125–130.
36. Lambrianidis T, Kosti E, Boutsioukis C, Mazinis M. 2006. Removal efficacy of various calcium hydroxide/chlorhexidinemedicaments from the root canal. International EndodonticJournal 39, 55–61.
37. Lavelle, C. 2005. Digital Radiographic Images will Benefit EndodonticServices. Endod. Dent. Traumatol., núm. 11, pp. 253-260.
38. Lee SJ, Wu MK, Wesselink PR. 2004. The efficacy of ultrasonic irrigation to remove artificially placed dentine debris from different-sized simulated plastic root canals. Int Endod J 37(9):607-612.
39. Leoni GB, Versiani MA, Silva-Sousa YT, Bruniera JF, Pecora JD, Sousa-Neto MD. 2016. Ex vivo evaluation of four final irrigation protocols on the removal of hard-tissue debris from the mesial root canal system of mandibular first molars. Int Endod J. 40. Lins PD, Nogueira BC, Fagundes NC, Silva FR, Lima RR. 2015. Analysis of the effectiveness of calcium hydroxide removal with variation of technique and solvent vehicles. Indian J Dent Res. 26(3):304-308.
41. Mann, V., Rahbaran, S., Lewsey, J., & Gulabivala, K. 2008. Outcome of primary root canal treatment: systematic review of the literature Part 2. Influence of clinical factors. International Endodontic Journal, 41(1), 6-31.
42. Martinho FC, Nascimento GG, Leite FR, Gomes AP, Freitas LF, Camoes IC. 2015. Clinical influence of different intracanal medications on th1-type and th2-type cytokine responses in apical periodontitis. J Endod. 41(2):169-175.
43. Midena RZ, Garcia RB, Cavenago BC, Marciano MA, Minotti PG, Ordinola-Zapata R, Weckwerth PH, Andrade FB, Duarte MA. 2015. Analysis of the reaction of subcutaneous tissues in rats and the antimicrobial activity of calcium hydroxide paste used in association with different substances. J Appl Oral Sci. 23(5):508-514. 44. Mines P, Loushine RJ, West L. 2000. Use of the microscope in endodontics: A Report Based on a Questionnaire. J Endodon ;25 (11):755-8.
45. Mohammadi Z, Dummer PM . 2011. Properties and applications of calcium hydroxide in endodontics and dental traumatology. Int Endod J 44(8):697-730. 46. Mozo S, Llena C, Forner L. 2012. Review of ultrasonic irrigation in endodontics: increasing action of irrigating solutions. Med Oral Patol Oral Cir Bucal 17(3):e512-516.
47. Nagas E, Cehreli ZC, Uyanik MO, Vallittu PK, Lassila LV. 2016. Effect of several intracanal medicaments on the push-out bond strength of proroot mta and biodentine. Int Endod J. 49(2):184-188.
48. Nandini S, Velmurugan N, Kandaswamy D. 2006. Removalefficiency of calcium hydroxide intracanal medicamentwith two calcium chelators: volumetric analysis usingspiral CT, an in vitro study. Journal of Endodontics 32,1097–101. 49. Ozcelik B, Tasman F, Ogan C. 2000. A comparison of the surface tension of calcium hydroxide mixed with different vehicles. J Endod. 26(9):500-502.
50. Pedullà, E., Grande, N. M., Plotino, G., Gambarini, G., & Rapisarda, E. 2013. Influence of continuous or reciprocating motion on cyclic fatigue resistance of 4 different nickel-titanium rotary instruments. J Endod, 39(2), 258-261. doi:10.1016/j.joen.2012.10.025
51. Plotino G, Pameijer CH, Grande NM, Somma F. 2007. Ultrasonics in endodontics: a review of the literature. J Endod 33(2):81-95.
52. Priya, N. T., Chandrasekhar, V., Anita, S., Tummala, M., Raj, T. B., Badami, V., Soujanya, E. 2014. Dentinal microcracks after root canal preparation a comparative evaluation with hand, rotary and reciprocating instrumentation. J Clin Diagn Res, 8(12), ZC70-72.
53. Rengo S, Carano A, Giorgetti M, Simeone M, Valletta R. 2000. Ultrasound in endodontics: S.E.M. verification. GItal Endod 4(4):29-35.
54. Rodig T, Hirschleb M, Zapf A, Hulsmann M. 2011. Comparison of ultrasonic irrigation and rinsendo for the removal of calcium hydroxide and ledermix paste from root canals. Int Endod J. 44(12):1155-1161.
55. Safavi K, Nakayama TA. 2000. Influence of mixing vehicle on dissociation of calcium hydroxide in solution. J Endod 26(11):649-651.
56. Segato RA, Pucinelli CM, Ferreira DC, Daldegan Ade R, Silva RS, Nelson-Filho P, Silva LA. 2016. Physicochemical properties of root canal filling materials for primary teeth. Braz Dent J. 27(2):196-201.
57. Selden HS. 2001. The role of a dental microscope in improved nonsurgical treatment of calcified canals. Oral Surg Oral Med Oral Pahol;68:93-8.
58. Silva L, Pessoa O, Teixeira M, Gouveia C and Braja R. 2015. Micro-CT evaluation of calcium hydroxide removalthrough passive ultrasonic irrigation associated with or without an additional instrument. Int Endod J.
59. Siqueira JF, Lopes HP. 2000. Mechanisms of antimicrobial activity of calcium hydroxide: a critical review. Int Endod J 32(5):361-369.
60. Sjögren U, Figdor D, Spångberg L, Sundqvist G. 2001. The antimicrobial effect of calcium hydroxide as a short-ter intracanal dressing. Int Endod J24(3):119-125. 61. Taşdemir T, Celik D, Er K, Yildirim T, Ceyhanli KT, Yeşilyurt C. 2011. Efficacy of several techniques for the removal of calcium hydroxide medicament from root canals. Int Endod J 44(6):505-509.
62. Turker, S. A., Uzunoğlu, E., & Sağlam, B. C. 2015. Evaluation of the amount of apically extruded debris during retreatment of root canals filled by different obturation techniques. Niger J Clin Pract, 18(6), 802-806.
63. Van der Sluis LW, Wu MK, Wesselink PR. 2005. The efficacy of ultrasonic irrigation to remove artificially placed dentine debris from human root canals prepared using instruments of varying taper. Int Endod J 38(10):764-768.
64. Van der Sluis LW, Gambarini G, Wu MK, Wesselink PR. 2006. The influence of volume, type of irrigant and flushing method on removing artificially placed dentine debris from the apical root canal during passive ultrasonic irrigation. Int Endod J 39(6):472-476.
65. Van der Sluis LW, Versluis M, Wu MK, Wesselink PR. 2007a. Passive ultrasonic irrigation of the root canal: a review of the literature. Int Endod J 40(6):415-426. 66. Van der Sluis LW, Wu MK, Wesselink PR. 2007b. The evaluation of removal of calcium hydroxide paste from an artificial standardized groove in the apical root canal using different irrigation methodologies. Int Endod J 40(1):52-57.
67. Vázquez, José. (2002). Microscope Applications in Current Endodontics Int Endod J. RCOE, 7(3), 301-305.
68. Weller RN, Brady JM, Bernier WE. 2000. Efficacy of ultrasonic cleaning. J Endod 6(9):740-743.
69. Wiseman A, Cox TC, Paranjpe A, Flake NM, Cohenca N,Johnson JD. 2011. Efficacy of sonic and ultrasonic activationfor removal of calcium hydroxide from mesial canalsof mandibular molars: a microtomographic study. Journalof Endodontics 37, 235–8.
70. Yoshimine, Y., Ono, M., & Akamine, A. 2005. The shaping effects of three nickel-titanium rotary instruments in simulated S-shaped canals. J Endod, 31(5), 373-375.
71. Yucel AC, Gurel M, Guler E, Karabucak B. 2013. Comparison of final irrigation techniques in removal of calcium hydroxide. Aust Endod J. 39(3):116-121.







